Nye dynamiske sonder til ioner, der interagerer med biomolekyler
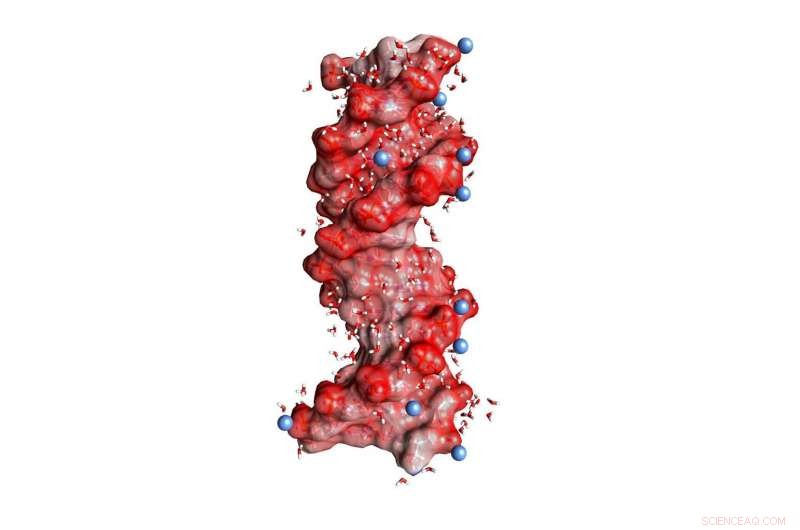
Fig. 1:DNA dobbelt helix indlejret i vand (vinklede små molekyler, ikke i skala). De mørkerøde kugler på helixoverfladen repræsenterer oxygenatomer i de negativt ladede PO2-enheder, de blå kugler positivt ladede ioner i miljøet. Kredit:MBI Berlin
Par af negativt ladede fosfatgrupper og positive magnesiumioner repræsenterer et centralt strukturelt træk ved DNA og RNA indlejret i vand. Vibrationer af fosfatgrupper er nu blevet etableret som selektive prober af sådanne kontaktpar og giver mulighed for en kortlægning af interaktioner og struktur på de ultrahurtige tidsskalaer for molekylær dynamik.
DNA og RNA er ladede polymerer, der koder for genetisk information i en dobbelt helixstruktur og fungerer som nøglespiller i biosyntesen af proteiner. Deres negative ladninger er placeret i den molekylære rygrad, som består af ionisk fosfat (PO 2- ) og af sukkergrupper (figur 1). Stabilisering af de makromolekylære strukturer af DNA og RNA kræver en kompensation af stærke frastødende elektriske kræfter mellem de ligeligt ladede fosfatgrupper med ioner af modsatte, dvs. positiv ladning. I denne sammenhæng, magnesium (Mg 2+ ) ioner er særligt relevante, da de ikke kun stabiliserer strukturen, men også medierer genkendelsen af eksterne bindingspartnere og fungerer som katalytiske centre. I øvrigt, ændringer af makromolekylær struktur via dynamiske foldningsprocesser er forbundet med en omlejring af positive ioner indlejret i den omgivende vandskal.
Positive ioner er arrangeret i forskellige geometrier omkring DNA og RNA:i såkaldte site-bundne eller kontakt-par geometrier, en positiv ion er placeret i direkte kontakt med et oxygenatom i en fosfatgruppe. I modsætning, den såkaldte ydre ionatmosfære består af positive ioner adskilt af mindst et lag af vandmolekyler fra fosfatgrupperne. Den funktionelle rolle af de forskellige geometrier og de underliggende interaktioner er langt fra at blive forstået. En dybere indsigt på molekylært niveau kræver meget følsomme prober, som gør det muligt at skelne de forskellige iongeometrier uden at forstyrre dem, og for at kortlægge deres dynamik på den ultrahurtige tidsskala for molekylære bevægelser.

Fig. 2:Øverst:Molekylær struktur af et kontaktionpar bestående af dimethylphosphat (DMP) og en magnesiumion Mg2 indlejret i vand. Pilene markerer forlængelserne af fosfor-ilt-bindingerne i den asymmetriske PO2-strækkende vibration. Nederst:Todimensionelle infrarøde (2D-IR) spektre af den asymmetriske PO2-strækvibration målt ved en ventetid T=500 fs efter vibrationsexcitation. Vibrationsresponsen er vist som en funktion af den infrarøde excitation og detektionsfrekvenserne og består af en komponent P1 fra DMP-molekyler uden en magnesiumion i nærheden og bidraget P2 fra kontaktionpar. Sidstnævnte forskydes til højere frekvenser på grund af interaktionen mellem PO2- og Mg2. Kredit:MBI Berlin
I en nylig udgivelse, forskere fra Max Born Institute (MBI) viser, at vibrationer af fosfatgrupper repræsenterer følsomme og ikke-invasive sonder af iongeometrier i et vandmiljø. Dimethylphosphat (DMP, (CH 3 O)2PO 2- ), et etableret modelsystem for DNA- og RNA-rygraden, blev fremstillet i flydende vand med et overskud af Mg 2+ ioner (figur 2, top) og studeret ved ikke-lineær vibrationsspektroskopi i femtosekundtidsdomænet (1 fs =10 -15 s). Forsøgene gør brug af todimensionel infrarød (2-D-IR) spektroskopi, en mest sofistikeret metode til at analysere de ioniske interaktioner og strukturer på den iboende tidsskala af fluktuerende molekylære bevægelser.
Forsøgene kortlægger Mg 2+ ioner i direkte kontakt med en PO 2- gruppe via en særskilt funktion i 2-D-IR-spektret (figur 2, bund). Interaktionen med Mg 2+ ion forskyder den asymmetriske PO 2- strække vibrationer til en frekvens, der er højere end i fravær af Mg 2+ ioner. Linjeformen og tidsudviklingen af denne nye funktion afslører fluktuationer i kontaktionparrets geometri og den indlejrede vandskal på en tidsskala på hundredvis af femtosekunder, mens selve kontaktparret eksisterer i meget længere tid (~10 -6 s). En dybdegående teoretisk analyse viser, at den subtile balance mellem attraktive elektrostatiske (Coulomb) kræfter og frastødende kræfter på grund af den kvantemekaniske udvekslingsinteraktion styrer fosfatvibrationens frekvensposition.
Evnen til 2-D-IR spektroskopi til at karakterisere den kortgående fosfat-ion-interaktion i opløsning giver et nyt analytisk værktøj, der komplementerer de nuværende tilgængelige strukturelle teknikker. En udvidelse af denne nye tilgang til DNA og RNA og deres ioniske miljø er mest lovende og forventes at give ny indsigt i de kræfter, der stabiliserer ligevægtsstrukturer og driver foldningsprocesser.
Sidste artikelForsker i rengøringsmiddel, mere effektiv bioenergiproduktion ved hjælp af neutroner
Næste artikelHvor farlig er mikroplast?
 Varme artikler
Varme artikler
-
 Sådan finder du antallet af orbitaler i hvert energiniveauOrbitaler, og hvor mange elektroner hver har, er central i processen med kemisk binding, og fra et fysisk perspektiv er orbitaler tæt bundet til energiniveauet for elektronerne i det pågældende ato
Sådan finder du antallet af orbitaler i hvert energiniveauOrbitaler, og hvor mange elektroner hver har, er central i processen med kemisk binding, og fra et fysisk perspektiv er orbitaler tæt bundet til energiniveauet for elektronerne i det pågældende ato -
 Gennem skueglasset:Nye spejlbillede-molekyler kan føre til bedre medicinDette peptid består af tre aminosyrer:Aspartinsyre (Asp), Valin (Val) og Serine (Ser). Den naturlige L-form er til venstre og den syntetiske D-form er til højre Kredit:Pablo Gainza University of T
Gennem skueglasset:Nye spejlbillede-molekyler kan føre til bedre medicinDette peptid består af tre aminosyrer:Aspartinsyre (Asp), Valin (Val) og Serine (Ser). Den naturlige L-form er til venstre og den syntetiske D-form er til højre Kredit:Pablo Gainza University of T -
 Hvorfor popper balloner, når de sidder i en varm bil?Det er fint at hente heliumballoner fra en butik og tage dem med hjem i din bil, men det er bestemt ikke en god ide at lade dem stå i en varm bil til lang tid. Dette skyldes, at heliummolekyler bliver
Hvorfor popper balloner, når de sidder i en varm bil?Det er fint at hente heliumballoner fra en butik og tage dem med hjem i din bil, men det er bestemt ikke en god ide at lade dem stå i en varm bil til lang tid. Dette skyldes, at heliummolekyler bliver -
 Kvægs embryo regenererer fuldstændigt placenta-dannende cellerEt tidligt bovint embryo, der regenererer sine TE -celler, som senere vil udgøre en stor del af moderkagen. (Venstre:intakt, Midt:efter fjernelse af TE, Til højre:regenereret). Kredit:Kohri N. et al.,
Kvægs embryo regenererer fuldstændigt placenta-dannende cellerEt tidligt bovint embryo, der regenererer sine TE -celler, som senere vil udgøre en stor del af moderkagen. (Venstre:intakt, Midt:efter fjernelse af TE, Til højre:regenereret). Kredit:Kohri N. et al.,
- At kunne springe undervisningen over forbedrer nogle elevers præstationer, andre kæmper med mere a…
- Mælkevejenes urhistorie og dens fossile fund
- At være sikker på usikkerhed
- Nanomateriale giver robotter kamæleonhud
- At drive ydeevnen for nanosystemer til det yderste
- Kvantesensorer til højpræcisionsmagnetometri af superledere


