Mange elementer binder til kulstof ved at udveksle elektroner?
Mens mange elementer danner bindinger med kulstof ved deling Elektroner (kovalente bindinger), nogle elementer danner bindinger med kulstof ved overførsel Elektroner (ioniske bindinger).
Her er en sammenbrud:
* kovalente obligationer: De fleste elementer, der binder med kulstofform kovalente bindinger. Dette skyldes, at kulstof har en moderat elektronegativitet, hvilket betyder, at det ikke stærkt trækker elektroner mod sig selv. Dette resulterer i en deling af elektroner mellem kulstof og det andet element. Eksempler inkluderer:
* brint: Formularer kulbrinter som metan (CH4) og ethan (C2H6)
* ilt: Formularer kuldioxid (CO2) og kulhydrater som glukose (C6H12O6)
* nitrogen: Former organiske molekyler som aminosyrer og proteiner
* ioniske bindinger: Mens de er mindre almindelige, danner nogle elementer ioniske bindinger med kulstof. Dette sker, når elektronegativitetsforskellen mellem kulstof og det andet element er stort nok til, at det ene element kan "stjæle" et elektron fra det andet. Eksempler inkluderer:
* lithium: Formularer Lithium Carbide (LI2C2)
* natrium: Formularer natriumcarbid (Na2C2)
* magnesium: Formularer magnesiumcarbid (MG2C2)
Derfor, selvom udsagnet delvist er sandt, er det vigtigt at bemærke, at kulstof kan danne både kovalente og ioniske bindinger.
Sidste artikelHvorfor bruges elementer i gruppe 1 og 7 for det meste form af forbindelser?
Næste artikelHvad er fire metalliske ledere?
 Varme artikler
Varme artikler
-
 Hvorfor nogle grønne bliver brune i historiske malerierEt maleri, Noli me tangere af Angolo Bronzino (ca. 1560) (A), viser mørkfarvning af grønt kobberpigment i et lyseksponeret område (C), men ikke i et område beskyttet af rammen (B). Kredit:Tilpasset
Hvorfor nogle grønne bliver brune i historiske malerierEt maleri, Noli me tangere af Angolo Bronzino (ca. 1560) (A), viser mørkfarvning af grønt kobberpigment i et lyseksponeret område (C), men ikke i et område beskyttet af rammen (B). Kredit:Tilpasset -
 Kontaktsporingssystem for kemisk eksponering i miljøetEmory-forskere kunne identificere personer, der tog forskellige medikamenter, baseret på mønsteret af lægemiddelmetabolitter efterladt i kroppen. Medicinen omfattede acetaminophen, det antidepressive
Kontaktsporingssystem for kemisk eksponering i miljøetEmory-forskere kunne identificere personer, der tog forskellige medikamenter, baseret på mønsteret af lægemiddelmetabolitter efterladt i kroppen. Medicinen omfattede acetaminophen, det antidepressive -
 Usædvanligt sukker fra cyanobakterier virker som naturligt herbicidCyanobakterier i laboratoriet:Den nye aktive ingrediens blev isoleret fra kulturer af ferskvandscyanobakterien Synechococcus elongatus. Kredit:Klaus Brilisauer Forskere ved universitetet i Tübinge
Usædvanligt sukker fra cyanobakterier virker som naturligt herbicidCyanobakterier i laboratoriet:Den nye aktive ingrediens blev isoleret fra kulturer af ferskvandscyanobakterien Synechococcus elongatus. Kredit:Klaus Brilisauer Forskere ved universitetet i Tübinge -
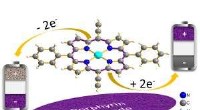 Naturligt molekyle til at øge ydeevnen af elektroder til genopladelige batterierPorphyrinmolekylet – brugt i elektroder – fremskynder opladningsprocessen af batterier i laboratoriet. Kredit:KIT/HIU Klorofyl, blod, og vitamin B12 er alle baseret på porfyrinmolekylet. Men por
Naturligt molekyle til at øge ydeevnen af elektroder til genopladelige batterierPorphyrinmolekylet – brugt i elektroder – fremskynder opladningsprocessen af batterier i laboratoriet. Kredit:KIT/HIU Klorofyl, blod, og vitamin B12 er alle baseret på porfyrinmolekylet. Men por
- Reagerer svovl med fortyndet HNO3?
- Hvad gør lymfesystemet?
- Hvordan man opretholder ligestilling mellem kønnene gennem kønskromosomerne
- Sådan laver du en jordnøddesmør fuglmater
- Undersøgelsen beskriver strategier for vellykkede byplantningsinitiativer
- Sådan fortæller du, hvis linjer er parallelle, vinkelret eller hverken


