Hvor mange gram kuldioxid produceres, når 23,5 g 1-heptanol reagerer med overskydende ilt i en forbrændingsreaktion?
1. Skriv den afbalancerede kemiske ligning:
Forbrændingen af 1-heptanol (C7H16O) producerer kuldioxid (CO2) og vand (H2O):
C7H16O + 10O2 → 7CO2 + 8H2O
2. Beregn den molære masse af 1-heptanol og kuldioxid:
* Molmasse 1-heptanol (C7H16O) =(7 * 12,01 g/mol) + (16 * 1,01 g/mol) + (1 * 16,00 g/mol) =116,21 g/mol
* Molmasse af kuldioxid (CO2) =(1 * 12,01 g/mol) + (2 * 16,00 g/mol) =44,01 g/mol
3. Bestem molforholdet mellem 1-heptanol og kuldioxid:
Fra den afbalancerede ligning producerer 1 mol 1-heptanol 7 mol kuldioxid.
4. Beregn molen på 1-heptanol:
* Mol 1-heptanol =(masse 1-heptanol) / (molmasse på 1-heptanol)
* Mol 1-heptanol =(23,5 g) / (116,21 g / mol) =0,202 mol
5. Beregn molen af det producerede kuldioxid:
* Mol CO2 =(mol 1-heptanol) * (molforhold mellem CO2 og 1-heptanol)
* Mol CO2 =(0,202 mol) * (7 mol CO2 / 1 mol 1-heptanol) =1,414 mol
6. Beregn massen af det producerede kuldioxid:
* Masse CO2 =(mol CO2) * (Molær masse af CO2)
* Masse CO2 =(1,414 mol) * (44,01 g/mol) = 62,2 g
Derfor produceres 62,2 gram kuldioxid, når 23,5 gram 1-heptanol reagerer med overskydende ilt.
 Varme artikler
Varme artikler
-
 SLACs højhastighedselektronkamera filmer molekylær film i HDForskere skabte den første film med atomopløsning af ringåbningsreaktionen af 1, 3-cyclohexadien (CHD) med et elektronkamera kaldet UED. Nederst:UED-elektronstrålen måler nøjagtigt afstandene mellem
SLACs højhastighedselektronkamera filmer molekylær film i HDForskere skabte den første film med atomopløsning af ringåbningsreaktionen af 1, 3-cyclohexadien (CHD) med et elektronkamera kaldet UED. Nederst:UED-elektronstrålen måler nøjagtigt afstandene mellem -
 Hurtige og pålidelige tests for legionellabakterier i vandKredit:Giovanni Cancemi, Shutterstock En fuldautomatisk testanordning kan nu installeres på vandsteder, der er mistænkt for forurening med legionella-bakterier. Enheden lover mere pålidelige resul
Hurtige og pålidelige tests for legionellabakterier i vandKredit:Giovanni Cancemi, Shutterstock En fuldautomatisk testanordning kan nu installeres på vandsteder, der er mistænkt for forurening med legionella-bakterier. Enheden lover mere pålidelige resul -
 Video:Hvordan tåregas påvirker din kropKredit:The American Chemical Society 2-chlorbenzalmalononitril, bedre kendt som CS-gas, er en af de mest almindelige tåregasser, der bruges i USA i dag, men vidste du, at det faktisk ikke er en
Video:Hvordan tåregas påvirker din kropKredit:The American Chemical Society 2-chlorbenzalmalononitril, bedre kendt som CS-gas, er en af de mest almindelige tåregasser, der bruges i USA i dag, men vidste du, at det faktisk ikke er en -
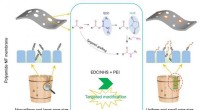 Ny målrettet modifikationsstrategi forbedrer selektiviteten af polyamid -nanofiltreringsmembranerDiagram over målrettet ændring af polyamid nanofiltreringsmembran Kredit:Wang Jingyu For nylig, en forskergruppe ledet af Prof. Undersøgelsen blev offentliggjort i Journal of Membrane Science de
Ny målrettet modifikationsstrategi forbedrer selektiviteten af polyamid -nanofiltreringsmembranerDiagram over målrettet ændring af polyamid nanofiltreringsmembran Kredit:Wang Jingyu For nylig, en forskergruppe ledet af Prof. Undersøgelsen blev offentliggjort i Journal of Membrane Science de
- Overfladeeffekter påvirker fordelingen af brint i metaller
- Sådan tager du 1.500 solbilleder på en fem minutters flyvning
- Vi vil aldrig tilgive dig:Ungdom er ikke spildt på de unge, der kæmper for klimaet
- Bøj mig, form mig, som du vil have mig:Forskere kurver nanopartikelark til komplekse former
- Hvilken slags rovdyr bor i prærie græsareal?
- Forskere afslører nye detaljer om, hvordan signaler transmitteres i hjernen


