Hvad sker der, når du blander platinoxygen og svovldioxid?
Her er en sammenbrud:
* Platinums rolle: Platinum fungerer som en katalysator. Katalysatorer fremskynder kemiske reaktioner uden at blive konsumeret selv. I dette tilfælde tilvejebringer platin en overflade, hvor svovldioxid- og iltmolekyler kan interagere lettere, hvilket sænker den aktiveringsenergi, der er nødvendig til reaktionen.
* reaktionen: Svovldioxid (SO₂) reagerer med ilt (O₂) i nærvær af platin for at danne svovltrioxid (SO₃).
* Ligningen: 2 SO₂ (G) + O₂ (G) → 2 SO₃ (G)
* Processen: Denne reaktion er det vigtigste trin i kontaktprocessen , en vigtig industriel proces til fremstilling af svovlsyre (H₂so₄).
Sådan fungerer kontaktprocessen:
1. svovl brændes i luft at fremstille svovldioxid (SO₂).
2. svovldioxid blandes derefter med luft (indeholdende ilt) og passeret over en platinekatalysator ved en høj temperatur (ca. 400-450 ° C). Det er her den katalytiske oxidation sker.
3. svovltrioxid (SO₃) absorberes i koncentreret svovlsyre at danne oleum (h₂s₂o₇).
4. oleum fortyndes derefter med vand At fremstille koncentreret svovlsyre (H₂so₄).
Hvorfor er dette vigtigt?
Svovlsyre er et meget vigtigt industrielt kemikalie, der bruges i en lang række anvendelser, herunder:
* Gødningsproduktion
* Metalbehandling
* Batteriproduktion
* Farvestof- og pigmentfremstilling
* Papirproduktion
Vigtig note:
Reaktionen af svovldioxid med ilt i nærvær af platin er meget eksoterm, hvilket betyder, at den frigiver en masse varme. Omhyggelig temperaturstyring er vigtig for at forhindre, at katalysatoren bliver for varm og mister dens effektivitet.
Sidste artikelHvilken grad skifter Celsius vand fra væske til gas?
Næste artikelEn gas ved den samme temperatur som flydende tilstand?
 Varme artikler
Varme artikler
-
 Ny type plast fremstillet af genvundet affaldSammensat og granuleret polyhydroxybutyrat (PHB). Kredit:Fraunhofer-Gesellschaft En ny type plast fremstillet af genvundet affald nedbrydes let på mindre end et år. Det stof, der snart vil tjene t
Ny type plast fremstillet af genvundet affaldSammensat og granuleret polyhydroxybutyrat (PHB). Kredit:Fraunhofer-Gesellschaft En ny type plast fremstillet af genvundet affald nedbrydes let på mindre end et år. Det stof, der snart vil tjene t -
 Redder liv med næbdyrmælkNæbdyret tilhører monotreme familien, en lille gruppe pattedyr, der lægger æg og producerer mælk for at fodre deres unger. Kredit:Laura Romin og Larry Dalton. Et gennembrud fra australske videnska
Redder liv med næbdyrmælkNæbdyret tilhører monotreme familien, en lille gruppe pattedyr, der lægger æg og producerer mælk for at fodre deres unger. Kredit:Laura Romin og Larry Dalton. Et gennembrud fra australske videnska -
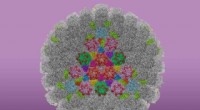 Studiet producerer de klareste billeder til dato af HSV-1, virus, der forårsager forkølelsessårForskere brugte en metode kaldet subparticle raffinement til at fange detaljerede strukturelle oplysninger om HSV-1 partiklen. Kredit:California NanoSystems Institute ved UCLA UCLA-forskere har pr
Studiet producerer de klareste billeder til dato af HSV-1, virus, der forårsager forkølelsessårForskere brugte en metode kaldet subparticle raffinement til at fange detaljerede strukturelle oplysninger om HSV-1 partiklen. Kredit:California NanoSystems Institute ved UCLA UCLA-forskere har pr -
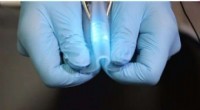 Sådan ser et stretchy kredsløb udForskere i Kina har lavet et nyt hybrid ledende materiale - del elastisk polymer, del flydende metal - der kan bøjes og strækkes efter ønske. Kredsløb lavet med dette materiale kan have de fleste todi
Sådan ser et stretchy kredsløb udForskere i Kina har lavet et nyt hybrid ledende materiale - del elastisk polymer, del flydende metal - der kan bøjes og strækkes efter ønske. Kredsløb lavet med dette materiale kan have de fleste todi


