En gas ved den samme temperatur som flydende tilstand?
* faseovergange: Overgangen mellem en væske og en gas (eller omvendt) forekommer ved en bestemt temperatur og tryk kaldet kogepunkt For væsker og kondensationspunkt For gasser.
* Energiniveau: Molekyler i en gas har meget højere kinetisk energi (bevægelsesenergi) end molekyler i en væske. For at blive en gas har molekyler brug for nok energi til at overvinde de attraktive kræfter, der holder dem sammen i flydende tilstand.
Hvad kan der ske:
* ligevægt: Ved kogepunktet kan der findes en væske og dens gas i ligevægt. Dette betyder, at molekyler konstant skifter mellem væske- og gasfaser i samme hastighed, så der er ingen nettoændring i mængden af hver. Væsken og gassen er dog stadig ved den samme temperatur (kogepunktet).
* overophedning: I sjældne tilfælde kan en væske opvarmes over dens kogepunkt uden kogning. Dette kaldes overophedning, og det er en ustabil tilstand. Enhver forstyrrelse, som en pludselig bevægelse eller introduktion af en urenhed, kan få væsken til hurtigt at koge og fordampe.
Kortfattet: Mens en væske og gas kan eksistere ved det samme tryk ved kogepunktet, kan de ikke eksistere ved nøjagtigt samme temperatur, medmindre væsken overophedes.
Sidste artikelHvad sker der, når du blander platinoxygen og svovldioxid?
Næste artikelHvad er det kemiske formel svovlmolekyle?
 Varme artikler
Varme artikler
-
 Sikrere, længerevarende energilagring kræver fokus på grænsefladen mellem avancerede materialerEn fremadrettet anmeldelse opfordrer forskere til at studere elektrode-ionisk væskekobling, som forekommer ved grænsefladen mellem elektroder og elektrolytter, når man udvikler sig mere sikkert, mere
Sikrere, længerevarende energilagring kræver fokus på grænsefladen mellem avancerede materialerEn fremadrettet anmeldelse opfordrer forskere til at studere elektrode-ionisk væskekobling, som forekommer ved grænsefladen mellem elektroder og elektrolytter, når man udvikler sig mere sikkert, mere -
 Forskere tager fat på miljøforvitring af mikroplast, optagelse af forurenende stofferGrafisk abstrakt. Kredit:ACS Environmental Au (2022). DOI:10.1021/acsenvironau.2c00036 I et nyt papir fra fakultet og studerende i LSU Chemical Engineering and Chemistry offentliggjort i ACS Enviro
Forskere tager fat på miljøforvitring af mikroplast, optagelse af forurenende stofferGrafisk abstrakt. Kredit:ACS Environmental Au (2022). DOI:10.1021/acsenvironau.2c00036 I et nyt papir fra fakultet og studerende i LSU Chemical Engineering and Chemistry offentliggjort i ACS Enviro -
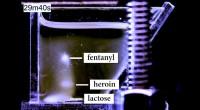 Ny teknologi kan hjælpe retshåndhævelsen med at opdage mindre mængder fentanyl med en højere gr…MagLev er billigere, mere følsomme, og hurtigere end de fleste lægemiddeltestteknologier. Kredit:Christoffer Abrahamsson/Michael Fink To år siden, Cambridge Police Detective Sgt. Louis Cherubino f
Ny teknologi kan hjælpe retshåndhævelsen med at opdage mindre mængder fentanyl med en højere gr…MagLev er billigere, mere følsomme, og hurtigere end de fleste lægemiddeltestteknologier. Kredit:Christoffer Abrahamsson/Michael Fink To år siden, Cambridge Police Detective Sgt. Louis Cherubino f -
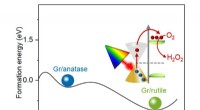 Forbedring af hydrogenperoxidproduktion gennem bæredygtig fotokatalyseForskere ved Shanghai Jiao Tong University fandt måder at få de varme elektroner til at holde længere, så fotokatalyse kan bruges til at producere hydrogenperoxid i en sikrere, renere produktionsproce
Forbedring af hydrogenperoxidproduktion gennem bæredygtig fotokatalyseForskere ved Shanghai Jiao Tong University fandt måder at få de varme elektroner til at holde længere, så fotokatalyse kan bruges til at producere hydrogenperoxid i en sikrere, renere produktionsproce
- Modvillig helt? Rensefisk viser, at det kan betale sig at være uselvisk
- Sådan beregnes ligevægt Constant
- Forskere afslører hemmeligheder om, hvordan Alaskas Denali-fejl opstod
- COVID-19 afslører yderligere uligheder i det globale finansielle system
- Hvad er den estimerede størrelse på Mælkevejen?
- Hvordan tilpasses planter til sandklitmiljø?


