Hvorfor er fluor mest elektronegativ end ilt?
Elektronegativitet:
* Definition: Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner mod sig selv, når det danner en kemisk binding.
* Trend: Elektronegativitet øges, når du bevæger dig over en periode (fra venstre til højre) og falder, når du bevæger dig ned ad en gruppe i den periodiske tabel.
Hvorfor fluor er det mest elektronegative:
* lille atomstørrelse: Fluor har en meget lille atomradius, hvilket betyder, at dens kerne er tættere på valenselektronerne. Dette resulterer i en stærkere attraktion mellem kernen og elektronerne.
* høj effektiv nuklearafgift: Fluor har en høj effektiv nuklear ladning. Dette betyder, at valenselektroner oplever et stærkt træk fra kernen, hvilket yderligere forbedrer dens evne til at tiltrække elektroner.
* Høj ioniseringsenergi: Fluor har en meget høj ioniseringsenergi, hvilket betyder, at den kræver en masse energi for at fjerne en elektron. Dette indikerer et stærkt greb på dens elektroner.
Oxygen's elektronegativitet:
* Oxygen er også meget elektronegativ, men mindre end fluor.
* Mens ilt er mindre end elementerne nedenfor i den samme gruppe, er den større end fluor.
* Dens effektive atomafgift er også lavere end fluor.
Kortfattet:
Fluorens unikke kombination af en lille atomstørrelse, høj effektiv nuklear ladning og energi med høj ionisering fører til dens ekstraordinære elektronegativitet, hvilket gør det til det mest elektronegative element. Oxygen, selvom den er meget elektronegativ, har ikke den samme kombination af faktorer for at opnå det samme niveau af elektron-tiltrækningskraft.
 Varme artikler
Varme artikler
-
 Bedre katalysatorer for en bæredygtig bioøkonomiVitaly Sushkevich (til venstre) og Manoj Ravi i zeolitlaboratoriet på PSI, holder en model af en standard zeolit. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer Instit
Bedre katalysatorer for en bæredygtig bioøkonomiVitaly Sushkevich (til venstre) og Manoj Ravi i zeolitlaboratoriet på PSI, holder en model af en standard zeolit. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer Instit -
 Biobaseret forbindelse tilbyder et grønnere kulfiberalternativDen her viste katalytiske reaktor er til omdannelse af kemiske mellemprodukter til acrylonitril. Arbejdet er en del af Renewable Carbon fiber Consortium. Kredit:Dennis Schroeder/NREL Fra biler og
Biobaseret forbindelse tilbyder et grønnere kulfiberalternativDen her viste katalytiske reaktor er til omdannelse af kemiske mellemprodukter til acrylonitril. Arbejdet er en del af Renewable Carbon fiber Consortium. Kredit:Dennis Schroeder/NREL Fra biler og -
 Skies of blue:Genanvendelse af kulstofemissioner til nyttige kemikalier og reduktion af den globale …Tilførsel af proton øger CO-elektrosyntesen til produktion af acetat og flygtige fedtsyrer. Kredit:Pusan National University Hurtig global urbanisering har dramatisk ændret vores planets ansigt,
Skies of blue:Genanvendelse af kulstofemissioner til nyttige kemikalier og reduktion af den globale …Tilførsel af proton øger CO-elektrosyntesen til produktion af acetat og flygtige fedtsyrer. Kredit:Pusan National University Hurtig global urbanisering har dramatisk ændret vores planets ansigt, -
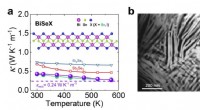 Ekstremt lav varmeledningsevne i 1-D blød kædestruktur(a) Den termiske ledningsevne som funktion af temperaturen. Insert er kædestrukturen af BiSeI. (b) Morfologien af trådformede kæder i 1D BiSeI. Kredit:©Science China Press Forskere har rapport
Ekstremt lav varmeledningsevne i 1-D blød kædestruktur(a) Den termiske ledningsevne som funktion af temperaturen. Insert er kædestrukturen af BiSeI. (b) Morfologien af trådformede kæder i 1D BiSeI. Kredit:©Science China Press Forskere har rapport
- Hvad er seks porøse stoffer?
- Forskere opdager en blazarlignende Seyfert 1-galakse med smal linje
- Nye jordskælvsforkastningsmodeller viser, at 'stabile' zoner kan bidrage til generering af massive …
- Organismer lavet af prokaryotiske celler findes i hvilket rige?
- Hvad er en konstellation for moderne astronomer?
- Hvilken planet har bjerge dals sletter og kontinenter, men ikke vand?


