De kemiske egenskaber ved calcium ligner mest?
Her er hvorfor:
* Periodiske tendenser: Elementer i den samme gruppe deler lignende elektronkonfigurationer i deres yderste energiniveau. Denne lighed i elektronkonfiguration er den primære faktor, der bestemmer et elements kemiske opførsel.
* Calciums gruppe: Calcium hører til gruppe 2 i den periodiske tabel, også kendt som de alkaliske jordmetaller.
* Lignende egenskaber: Andre alkaliske jordmetaller som magnesium (Mg), strontium (SR), barium (BA) og radium (RA) udviser lignende egenskaber som calcium på grund af deres lignende elektronkonfigurationer. Disse egenskaber inkluderer:
* reaktivitet: De er alle reaktive metaller, der let reagerer med vand og syrer.
* Dannelse af ioner: De har en tendens til at miste deres to yderste elektroner til dannelse af +2 ioner.
* Dannelse af forbindelser: De danner lignende forbindelser med andre elementer.
Derfor er de kemiske egenskaber ved calcium mest ligner dem med magnesium, strontium, barium og radium.
Sidste artikelHvor mange hydrogenatomer findes i formlen for ammoniumsulfat?
Næste artikelHvad er den del af kernen, der væske?
 Varme artikler
Varme artikler
-
 Marangoni-effekten kan bruges til at få ferskvand fra havetKredit:CC0 Public Domain En undersøgelse udført på Politecnico di Torino, i samarbejde med Massachusetts Institute of Technology (MIT), og publiceret i tidsskriftet Energi- og miljøvidenskab , p
Marangoni-effekten kan bruges til at få ferskvand fra havetKredit:CC0 Public Domain En undersøgelse udført på Politecnico di Torino, i samarbejde med Massachusetts Institute of Technology (MIT), og publiceret i tidsskriftet Energi- og miljøvidenskab , p -
 Forskere udvikler papirbaserede arrays med høj kapacitet af 3D-tumormodellerKredit:NYU Abu Dhabi Ved at udvikle almindelige filterpapirer, ligner kaffefiltre, et team af NYU Abu Dhabi-forskere har skabt arrays med høj gennemstrømning af miniaturiserede 3-D-tumormodeller f
Forskere udvikler papirbaserede arrays med høj kapacitet af 3D-tumormodellerKredit:NYU Abu Dhabi Ved at udvikle almindelige filterpapirer, ligner kaffefiltre, et team af NYU Abu Dhabi-forskere har skabt arrays med høj gennemstrømning af miniaturiserede 3-D-tumormodeller f -
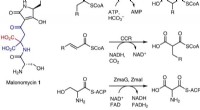 Forskere opdager en ny vej til antibiotika ved hjælp af genredigeringen, Malonomycin 1 indeholder en intakt aminomalonatdel. b, Biosyntese af malonater i primær og sekundær metabolisme (R = H eller alkyl). c, Foreslået mekanisme af pattedyret VKDC. Phylloquinoner (vita
Forskere opdager en ny vej til antibiotika ved hjælp af genredigeringen, Malonomycin 1 indeholder en intakt aminomalonatdel. b, Biosyntese af malonater i primær og sekundær metabolisme (R = H eller alkyl). c, Foreslået mekanisme af pattedyret VKDC. Phylloquinoner (vita -
 Ny metode til at fremme biofilmdannelse og øge effektiviteten af biokatalyseForskerne screenede syntetiske polymerer for deres evne til at inducere biofilmdannelse i en stamme af E. coli (MC4100), som er kendt for at være dårlig til at danne biofilm. De overvågede også biomas
Ny metode til at fremme biofilmdannelse og øge effektiviteten af biokatalyseForskerne screenede syntetiske polymerer for deres evne til at inducere biofilmdannelse i en stamme af E. coli (MC4100), som er kendt for at være dårlig til at danne biofilm. De overvågede også biomas


