Intracellulært nanotermometer har hidtil uset alsidighed
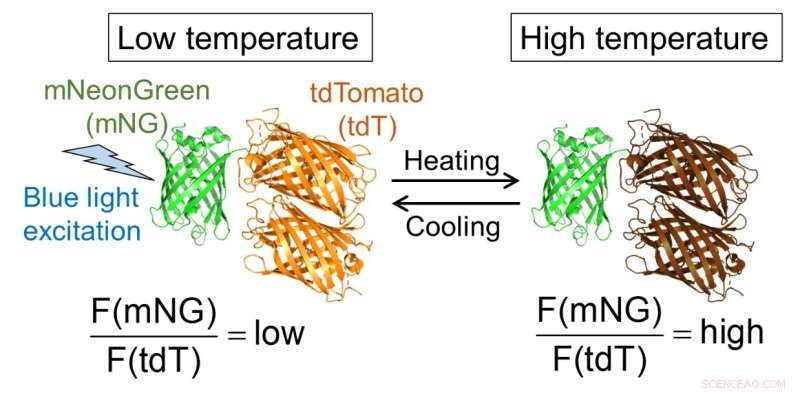
Fig.1. Molekylært design af B-gTEMP og det forventede fluorescensrespons på temperatur. F(mNG) og F(tdT) er fluorescensintensiteten af henholdsvis mNeonGreen og tdTomato. Kredit:Kai Lu et al.
Kropstemperatur er en grundlæggende indikator for sundhed. Intracellulær temperatur er også en grundlæggende indikator for cellulær sundhed; kræftceller er mere metabolisk aktive, og kan dermed have en lidt højere temperatur end raske celler. Men indtil nu har de tilgængelige værktøjer til at teste sådanne hypoteser ikke været op til opgaven. I en undersøgelse for nylig offentliggjort i Nano Letters , forskere fra Osaka University og samarbejdspartnere har eksperimentelt målt temperaturgradienter i menneskelige celler og med hidtil uset præcision. Denne undersøgelse vil åbne op for nye retninger inden for lægemiddelopdagelse og medicinsk forskning.
Mange forskere har mistænkt, at forbigående intracellulære temperaturgradienter har en bredere effekt på menneskers sundhed end almindeligt anerkendt, men var ude af stand til at teste deres hypoteser på grund af begrænsningerne af den teknologi, der er til rådighed for dem. "Nuværende intracellulær termisk detektionsteknologi har utilstrækkelig rumlig, tidsmæssig og udlæsningsopløsning til at besvare nogle langvarige medicinske hypoteser," forklarer Kai Lu, hovedforfatter, "men vores forskning ændrer dette. Vores genetisk kodede fluorescerende nanotermometer overvinder tidligere tekniske forhindringer og vil være uvurderlig til at teste sådanne hypoteser."
Forskernes proteinbaserede nanotermometer er baseret på moduleret fluorescensoutput, der er følsomt over for små ændringer i temperaturen i celler. Dens udlæsningshastighed er mindst 39 gange hurtigere end sammenlignelig teknologi og tusind gange hurtigere end et typisk øjenblink. Nanotermometeret gjorde det muligt for forskerne at opdage, at intracellulær varmediffusion er mere end 5 gange langsommere end varmediffusion i vand. Det viste også, at udlæsningsopløsningen kun er 0,042 grader Celsius ved fysiologisk temperatur, hvilket er en endnu højere opløsning end i en sammenlignelig opsætning, der er flere tusinde gange langsommere.
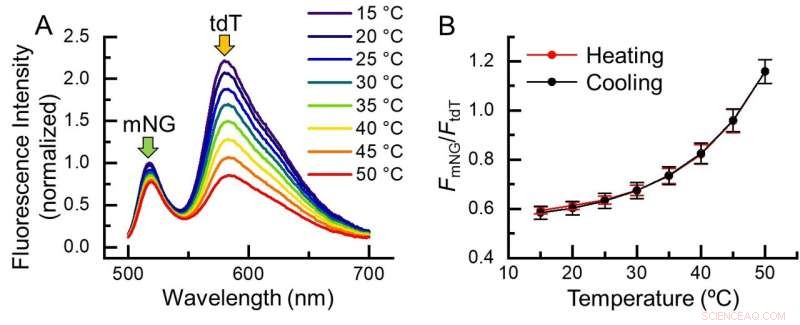
Fig. 2. Temperaturrespons af B-gTEMP. (A) Fluorescensspektrum af B-gTEMP ved forskellige temperaturer. mNG:mNeonGrøn; tdT:tdTomat. (B) Fluorescensintensitetsforhold mellem mNG og tdT som reaktion på temperaturen under en cyklus med opvarmning og afkøling. Kredit:Kai Lu et al.
"Vi testede hypotesen om, at der er en væsentlig temperaturforskel mellem cellekernen og cytoplasmaet," siger Takeharu Nagai, seniorforfatter. "Vi fandt ikke en signifikant forskel, men testbetingelser, der i højere grad efterligner typisk fysiologi, kan give forskellige resultater."
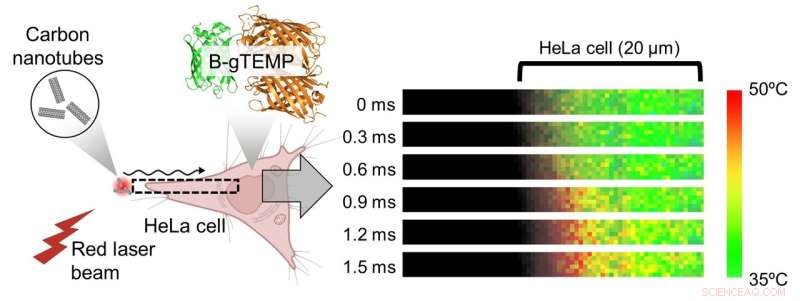
Fig. 3. Hurtig varmetransport i celler. Varme blev genereret ved at bestråle kulstof nanorør med en fokuseret rød laserstråle; varmen diffunderede derefter ind i den tilstødende HeLa-celle. Denne proces blev fanget i realtid ved hjælp af kilohertz temperaturbilleddannelse med B-gTEMP. Kredit:Kai Lu et al.
Der er flere midler til at forbedre funktionaliteten af forskernes nanotermometer. Den ene er at forbedre, hvor længe den holder under mikroskopisk belysning. En anden er at omkonstruere den til at være følsom over for rødt eller infrarødt lys og dermed være mindre skadelig for celler til langsigtet billeddannelse. I mellemtiden har forskere nu teknologien til realistisk at undersøge intracellulære temperaturgradienter og afdække den fysiologi, der understøtter disse gradienter. Måske med denne viden kan lægemidler en dag designes til at drage fordel af dette undervurderede aspekt af cellefysiologi. + Udforsk yderligere
Ultra-følsomt nanotermometer under omgivende forhold
 Varme artikler
Varme artikler
-
 Kemikere rapporterer om ny indsigt om egenskaber af stof på nanoskalaEn væske med en viskositet som vand trænger ind i UCLA-R3, hvor dens viskositet på nanoskala bliver som honning. Kredit:Xing Jiang, Miguel García-Garibay/UCLA Kemi og Biokemi UCLA nanovidenskabsfo
Kemikere rapporterer om ny indsigt om egenskaber af stof på nanoskalaEn væske med en viskositet som vand trænger ind i UCLA-R3, hvor dens viskositet på nanoskala bliver som honning. Kredit:Xing Jiang, Miguel García-Garibay/UCLA Kemi og Biokemi UCLA nanovidenskabsfo -
 Forskere hjælper med at bringe biovenlige materialer til lægemiddeldesign til neurolidelserBidragene fra forskere fra University of Texas i El Paso har givet den første indikation af, at kulstofkvanteprikker, en klasse af nanopartikler, kan bruges til at bekæmpe neurologiske lidelser. Kredi
Forskere hjælper med at bringe biovenlige materialer til lægemiddeldesign til neurolidelserBidragene fra forskere fra University of Texas i El Paso har givet den første indikation af, at kulstofkvanteprikker, en klasse af nanopartikler, kan bruges til at bekæmpe neurologiske lidelser. Kredi -
 Ny undersøgelse viser, at foldning af grafen forbedrer den mekaniske ydeevne betydeligtBritney Gallivan sidder oven på sit gigantiske stykke papir med 11 folder (til venstre) og sin ligning (til højre). Kredit:Britney Gallivan Et internationalt forskerteam, tilknyttet UNIST har opda
Ny undersøgelse viser, at foldning af grafen forbedrer den mekaniske ydeevne betydeligtBritney Gallivan sidder oven på sit gigantiske stykke papir med 11 folder (til venstre) og sin ligning (til højre). Kredit:Britney Gallivan Et internationalt forskerteam, tilknyttet UNIST har opda -
 Ny type nanosensor registrerer DNA-byggestenEt molekyles dipolmoment påvirker det elektriske potentiale af en atomkæde og dermed ændrer den elektriske strøm i materialet. Kredit:Ralph Scheicher Forskere ved Uppsala Universitet og i Brasilie
Ny type nanosensor registrerer DNA-byggestenEt molekyles dipolmoment påvirker det elektriske potentiale af en atomkæde og dermed ændrer den elektriske strøm i materialet. Kredit:Ralph Scheicher Forskere ved Uppsala Universitet og i Brasilie
- Stigningen i naturbrande er via klimaændringer forbundet med social ulighed
- Forskere skaber vaskbar sensor, der kan væves i materialer
- Forskerteam udvikler en højtydende quantum dot-låst laser på silicium
- DNA Lego klodser muliggør hurtig genskrivbar datalagring
- NASA kommer tæt på med Grønlands smeltende is
- Biofotoniske prober til biodetektion og billeddannelse


