Hvilken forbindelse indeholder både ioniske og kovalente bindinger En ammoniak B ammonium clhorid C hydrogenchlorid d natriumchlorid?
* ioniske bindinger: Ammoniumchlorid dannes af den elektrostatiske tiltrækning mellem den positivt ladede ammoniumion (NH₄⁺) og den negativt ladede chloridion (CL⁻). Dette er det definerende træk ved en ionisk binding.
* kovalente obligationer: Inden for ammoniumionen (NH₄⁺) er nitrogenatomet bundet til fire hydrogenatomer gennem delte elektronpar. Denne deling af elektroner er grundlaget for en kovalent binding.
Lad os se på de andre muligheder:
* a) Ammoniak (NH₃): Ammoniak indeholder kun kovalente bindinger mellem nitrogen og brintatomer.
* C) Hydrogenchlorid (HCL): Hydrogenchlorid indeholder en enkelt kovalent binding mellem brint og klor.
* D) natriumchlorid (NaCl): Natriumchlorid er et klassisk eksempel på en ionisk forbindelse med kun ioniske bindinger mellem natrium og klor.
Kortfattet: Ammoniumchlorid (NH₄CL) er den eneste forbindelse, der udviser både ioniske bindinger (mellem NH₄⁺ og CL⁻) og kovalente bindinger (inden for nh₄⁺ion).
Sidste artikelHvorfor er ammoniumchlorid et fast stof?
Næste artikelHvad er reaktionen, når natriumchlorid og ammoniumnitrat blandes?
 Varme artikler
Varme artikler
-
 Materiale til at hjælpe med overgangen til rent brintbrændstofTitaniumoxid-katalysatoren Kredit:University of Wollongong Planters evne til at høste sollys og spalte vand til brint og ilt gennem fotosyntese har længe fascineret videnskabsmænd, som har forsøgt
Materiale til at hjælpe med overgangen til rent brintbrændstofTitaniumoxid-katalysatoren Kredit:University of Wollongong Planters evne til at høste sollys og spalte vand til brint og ilt gennem fotosyntese har længe fascineret videnskabsmænd, som har forsøgt -
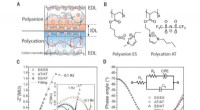 Ionotronisk teknologi, der ikke kræver flydende elektrolytterDannelse af en IDL ved grænsefladen mellem to modsat ladede ionoelastomerer. (A) Skematisk illustration af en polyanion/polykation-forbindelse. Kulstof-nanorørelektroder med stort overfladeareal er in
Ionotronisk teknologi, der ikke kræver flydende elektrolytterDannelse af en IDL ved grænsefladen mellem to modsat ladede ionoelastomerer. (A) Skematisk illustration af en polyanion/polykation-forbindelse. Kulstof-nanorørelektroder med stort overfladeareal er in -
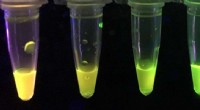 Kemikere udvikler papirbaserede sensorer til at detektere potente nervetoksinerEn ny sensor udviklet af U af A-kemikere bliver gul eller grøn under ultraviolet lys afhængigt af hvor meget parathion eller paraoxon der er til stede i en prøve. Kredit:Chris Robidillo En ny, pap
Kemikere udvikler papirbaserede sensorer til at detektere potente nervetoksinerEn ny sensor udviklet af U af A-kemikere bliver gul eller grøn under ultraviolet lys afhængigt af hvor meget parathion eller paraoxon der er til stede i en prøve. Kredit:Chris Robidillo En ny, pap -
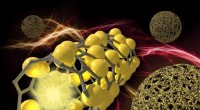 Et spring i at bruge silicium til batterianoderSiliciummikrosfærer har ekstraordinær mekanisk styrke på grund af tilsætning af kulnanorør, der får kuglerne til at ligne garnkugler. I denne repræsentation, billedet til venstre illustrerer et nærbil
Et spring i at bruge silicium til batterianoderSiliciummikrosfærer har ekstraordinær mekanisk styrke på grund af tilsætning af kulnanorør, der får kuglerne til at ligne garnkugler. I denne repræsentation, billedet til venstre illustrerer et nærbil
- Klimaændringernes indvirkning på tropisk fiskeri ville skabe krusninger over hele verden
- Hvad er et videnskabeligt instrument?
- Hvorfor bliver jorden ikke meget varm eller kold?
- En ny måde at skabe Saturns strålingsbælter på
- Computersimuleringer kaster lys over, hvordan immunceller identificerer fremmede antigener
- Forskere finder, at nyhedsdækning i Chicago devaluerer sorte og latinamerikanske liv uforholdsmæss…


