Har svovl et højt eller lavt kogepunkt?
Her er hvorfor:
* Stærke intermolekylære kræfter: Svovl findes som et fast stof i sin elementære form på grund af stærke van der Waals -kræfter mellem dens molekyler. Disse kræfter opstår fra den store størrelse og polariserbarhed af svovlatomer.
* octa-atomisk struktur: Svovlmolekyler i deres faste og flydende tilstande er ikke enkeltatomer, men snarere otte-atomringe (S 8 ). Denne komplekse struktur bidrager til den højere energi, der kræves for at bryde bindingerne og give molekylerne mulighed for at skifte til den gasformige fase.
Kogepunktet for svovl er 444,6 ° C (832,3 ° F). Dette er signifikant højere end kogepunkterne for mange andre elementer, såsom ilt (-183 ° C) eller nitrogen (-196 ° C) på grund af de ovenfor nævnte grunde.
Sidste artikelHvad er massen på 0,560 molsklorgas?
Næste artikelHar natriumchlorid et højt eller lavt kogepunkt?
 Varme artikler
Varme artikler
-
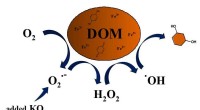 Superoxid producerer hydroxylradikaler, der nedbryder opløst organisk stof i vandSuperoxid kan drive autokatalytisk produktion af hydroxylradikaler i nærværelse af komplekser af naturligt opløst organisk stof og jern. I autokatalyse, hydroxylradikaler omdanner muligvis aromatiske
Superoxid producerer hydroxylradikaler, der nedbryder opløst organisk stof i vandSuperoxid kan drive autokatalytisk produktion af hydroxylradikaler i nærværelse af komplekser af naturligt opløst organisk stof og jern. I autokatalyse, hydroxylradikaler omdanner muligvis aromatiske -
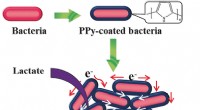 Ledende skal for bakterierKredit:Wiley Under anaerobe forhold, visse bakterier kan producere elektricitet. Denne adfærd kan udnyttes i mikrobielle brændselsceller, med særligt fokus på spildevandsbehandlingsordninger. Et s
Ledende skal for bakterierKredit:Wiley Under anaerobe forhold, visse bakterier kan producere elektricitet. Denne adfærd kan udnyttes i mikrobielle brændselsceller, med særligt fokus på spildevandsbehandlingsordninger. Et s -
 Kærlighed-had forhold mellem opløsningsmiddel og vand fører til bedre biomasseopløsningEt organisk opløsningsmiddel, vist med gult, og vand, vist i blåt, adskille og danne nanoklynger på de hydrofobe og hydrofile sektioner af grønt plantemateriale, driver den effektive dekonstruktion af
Kærlighed-had forhold mellem opløsningsmiddel og vand fører til bedre biomasseopløsningEt organisk opløsningsmiddel, vist med gult, og vand, vist i blåt, adskille og danne nanoklynger på de hydrofobe og hydrofile sektioner af grønt plantemateriale, driver den effektive dekonstruktion af -
 Video:Hvad er en elektron?Kredit:The American Chemical Society Når det kommer til elektroner - en af de grundlæggende byggesten i alt stof - er der masser af ubesvarede spørgsmål. Hvor store er de? Hvad er de lavet af? Hv
Video:Hvad er en elektron?Kredit:The American Chemical Society Når det kommer til elektroner - en af de grundlæggende byggesten i alt stof - er der masser af ubesvarede spørgsmål. Hvor store er de? Hvad er de lavet af? Hv


