Hvad er pH på 1N natriumhydroxid?
Forståelse af normalitet og pH
* Normalitet (n): Repræsenterer antallet af ækvivalenter af et opløst stof pr. Liter opløsning. For NaOH indeholder en mol en ækvivalent af hydroxidioner (OH-). Så en 1N -opløsning af NaOH er den samme som en 1M (1 molær) opløsning.
* ph: Et mål for surhedsgraden eller alkaliniteten af en opløsning. Det er baseret på koncentrationen af hydrogenioner (H+) i opløsningen.
Beregning af pH
1. dissociation: NaOH dissocierer fuldstændigt i vand og danner en natriumion (Na+) og en hydroxidion (OH-):
NaOH → Na + + OH-
2. hydroxidionkoncentration: Da en 1N-opløsning af NaOH indeholder 1 mol NaOH pr. Liter, er koncentrationen af OH-ioner også 1 M.
3. poh: POH er et mål for hydroxidionkoncentrationen:
poh =-log [oh-] =-log (1) =0
4. pH -beregning: PH og POH er relateret af følgende ligning:
Ph + POH =14
Derfor pH =14 - POH =14 - 0 =14
Konklusion
PH -værdien af en 1N -opløsning af natriumhydroxid er 14 . Dette indikerer en meget alkalisk opløsning.
Sidste artikelHvorfor er blychromat ikke opløselig i vand?
Næste artikelHvad er formålet med at tilføje NaCl -opløsning til sæbeblanding?
 Varme artikler
Varme artikler
-
 Dobbelt-duty-katalysator genererer brintbrændstof, mens den renser spildevandKredit:Pixabay/CC0 Public Domain Brint er en forureningsfri energikilde, når den udvindes fra vand ved hjælp af sollys i stedet for fossile brændstoffer. Men nuværende strategier til at spalte ell
Dobbelt-duty-katalysator genererer brintbrændstof, mens den renser spildevandKredit:Pixabay/CC0 Public Domain Brint er en forureningsfri energikilde, når den udvindes fra vand ved hjælp af sollys i stedet for fossile brændstoffer. Men nuværende strategier til at spalte ell -
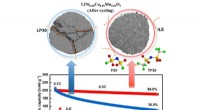 Ny kombination af materialer skaber rekordstore lithium-metalcellerDen ioniske flydende elektrolyt ILE (højre) forhindrer stort set strukturelle ændringer på den nikkelrige NCM88 katode. Efter 1000 cykler, batterikapacitet når stadig 88 procent. Kredit:Fanglin Wu og
Ny kombination af materialer skaber rekordstore lithium-metalcellerDen ioniske flydende elektrolyt ILE (højre) forhindrer stort set strukturelle ændringer på den nikkelrige NCM88 katode. Efter 1000 cykler, batterikapacitet når stadig 88 procent. Kredit:Fanglin Wu og -
 Forskere finder værdi i usædvanlig type plantematerialeKredit:CC0 Public Domain Et ideelt bioraffinaderi ville forvandle vedvarende afgrøder til en række forskellige brændstoffer og produkter med lidt affald. En væsentlig udfordring i at realisere den
Forskere finder værdi i usædvanlig type plantematerialeKredit:CC0 Public Domain Et ideelt bioraffinaderi ville forvandle vedvarende afgrøder til en række forskellige brændstoffer og produkter med lidt affald. En væsentlig udfordring i at realisere den -
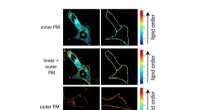 Lipidasymmetri spiller en nøglerolle i aktiveringen af immuncellerEn celles membran er sammensat af et dobbeltlag af lipider, og det indvendige vendende lag er lavet af andre lipider end det ydre vendende lag; forskellene i membranrækkefølge mellem det indvendige og
Lipidasymmetri spiller en nøglerolle i aktiveringen af immuncellerEn celles membran er sammensat af et dobbeltlag af lipider, og det indvendige vendende lag er lavet af andre lipider end det ydre vendende lag; forskellene i membranrækkefølge mellem det indvendige og
- NASA finder falmende subtropisk storm Beryl blottet for nedbør i midten
- Automatiseret system identificerer tæt væv, en risikofaktor for brystkræft, ved mammografi
- Hvordan er kløfter og sandklitter det samme?
- Virtuel virkelighedsturné vækker liv i Jerusalem fra den bibelske æra
- Hvilken pen bruges i rummet?
- Hvor mange kg i en quantel?


