Har elementer, der er forbindelser og blandinger, der fikserer kogepunktet?
elementer
* Fast smeltnings- og kogepunkter: Elementer har et specifikt, fast smeltnings- og kogepunkt. Dette skyldes, at de kun består af en type atom.
* Eksempel: Vand (H₂O) koger altid ved 100 ° C (212 ° F) ved standardtryk.
Forbindelser
* Fast smeltnings- og kogepunkter: Ligesom elementer har forbindelser også faste smeltnings- og kogepunkter. Dette skyldes, at de dannes af et specifikt forhold mellem forskellige elementer bundet sammen.
* Eksempel: Natriumchlorid (NaCI) smelter altid ved 801 ° C (1474 ° F).
blandinger
* Variabel smeltning og kogepunkter: Blandinger er kombinationer af forskellige stoffer, der ikke er kemisk bundet. De har en række smeltnings- og kogepunkter, ikke et enkelt fast punkt.
* Eksempel: Saltvand (salt opløst i vand) har en række kogepunkter afhængigt af koncentrationen af salt.
Hvorfor forskellene?
Forskellen ligger i strukturen og interaktioner mellem partikler:
* elementer og forbindelser: De stærke kemiske bindinger inden for disse stoffer kræver en bestemt mængde energi til at bryde, hvilket fører til faste smeltnings- og kogepunkter.
* Blandinger: De svagere intermolekylære kræfter (som hydrogenbinding) mellem komponenter i en blanding kan forstyrres ved forskellige energiniveauer. Dette betyder, at blandingen kan smelte eller koge over en række temperaturer.
Vigtig note:
* Urenheder kan påvirke smelte- og kogepunkterne for både elementer og forbindelser. For eksempel sænker tilsætning af salt til vand sit frysepunkt.
Fortæl mig, hvis du gerne vil have flere eksempler eller forklaringer!
 Varme artikler
Varme artikler
-
 Ny proteomikteknik giver indsigt i ubiquitin-signaleringEn ny proteomikteknik kaldet ubiquitin clipping giver forskere mulighed for at skabe high-definition kort over, hvordan proteiner modificeres ved en proces kaldet ubiquitination. Kredit:Walter og Eliz
Ny proteomikteknik giver indsigt i ubiquitin-signaleringEn ny proteomikteknik kaldet ubiquitin clipping giver forskere mulighed for at skabe high-definition kort over, hvordan proteiner modificeres ved en proces kaldet ubiquitination. Kredit:Walter og Eliz -
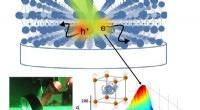 Ryste, rangle, og rulle til højeffektiv solcelleBrug af ultrahurtige infrarøde billedbehandlingsteknikker (nederst til venstre), et team af forskere fra Penn State har afsløret, at de bemærkelsesværdige elektroniske egenskaber af halogenidperovskit
Ryste, rangle, og rulle til højeffektiv solcelleBrug af ultrahurtige infrarøde billedbehandlingsteknikker (nederst til venstre), et team af forskere fra Penn State har afsløret, at de bemærkelsesværdige elektroniske egenskaber af halogenidperovskit -
 Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa
Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa -
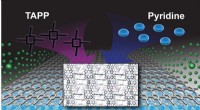 En bedre byggesten til at skabe nye materialerEn grafisk repræsentation af de kovalente organiske rammer, eller COFer, skabt af et samarbejdende team af eksperimentelle og teoretiske kemikere. Store porphyrinstrukturer (mærket som TAPP) danner et
En bedre byggesten til at skabe nye materialerEn grafisk repræsentation af de kovalente organiske rammer, eller COFer, skabt af et samarbejdende team af eksperimentelle og teoretiske kemikere. Store porphyrinstrukturer (mærket som TAPP) danner et
- Euronext topper Nasdaq -bud på Oslo -børsen
- Hvad er tre dele af en videnskabelig notation?
- Amerikanske tilsynsmyndigheder blokerer Telegram for at rejse penge gennem kryptokurrency
- Hvordan kan jeg sikre mig, at jeg praktiserer formørkelsesbilleder?
- Demon olie i defensiven over klimaændringer
- Californias Wildfires har gjort NorCals Air det værste i verden


