Ville det være korrekt at sige et molekyle af NaCl?
* ionisk binding: NaCl (natriumchlorid eller bordsalt) danner en ionisk binding. Dette betyder, at elektroner overføres fra natrium (NA) til klor (CL) til dannelse af modsat ladede ioner:Na+ og Cl-.
* Krystalgitter: Ioniske forbindelser som NaCl findes ikke som individuelle molekyler. I stedet danner de en enorm, gentagne krystalgitterstruktur. I denne struktur er hver Na+ -ion omgivet af flere kloder, og vice versa.
Derfor skal du henvise til NaCl som:
* En formelenhed for NaCl: Dette understreger det faste forhold mellem Na+ og Cl-ioner i forbindelsen.
* en krystal af NaCl: Dette afspejler nøjagtigt arten af den faste forbindelse.
Det er vigtigt at skelne mellem ioniske og kovalente forbindelser, når de beskriver deres strukturer. Kovalente forbindelser danner diskrete molekyler (som H2O eller CO2), mens ioniske forbindelser danner krystalgitter.
 Varme artikler
Varme artikler
-
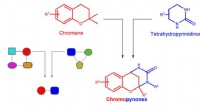 Inspirerende opdagelse af nye lægemidler med pseudo-naturprodukterDesign af chromopynon pseudo NPer. Fusion af chroman- og tetrahydropyrimidinonfragmenter. Kredit:MPI for molekylær fysiologi Næsten en tredjedel af de tilgængelige lægemidler er baseret på naturli
Inspirerende opdagelse af nye lægemidler med pseudo-naturprodukterDesign af chromopynon pseudo NPer. Fusion af chroman- og tetrahydropyrimidinonfragmenter. Kredit:MPI for molekylær fysiologi Næsten en tredjedel af de tilgængelige lægemidler er baseret på naturli -
 Sætte gas under trykEt udskåret billede af højtryksforbrændingskanalen. Vinduer (yderst til venstre og højre) indbygget i apparatet muliggør overvågning af gasforbrænding. Kredit:Gengivet med tilladelse fra reference 1.
Sætte gas under trykEt udskåret billede af højtryksforbrændingskanalen. Vinduer (yderst til venstre og højre) indbygget i apparatet muliggør overvågning af gasforbrænding. Kredit:Gengivet med tilladelse fra reference 1. -
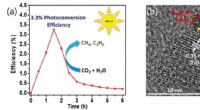 En-to-punch katalysatorer, der fanger kuldioxid til renere brændstofferBrændstofproduktionseffektivitet af titaniumdioxid fotokatalysator med kobber-platin legering co-katalysator (a) og et foto af fotokatalysator observeret af HRTEM (b) Kredit:©DGIST Kobber- og plat
En-to-punch katalysatorer, der fanger kuldioxid til renere brændstofferBrændstofproduktionseffektivitet af titaniumdioxid fotokatalysator med kobber-platin legering co-katalysator (a) og et foto af fotokatalysator observeret af HRTEM (b) Kredit:©DGIST Kobber- og plat -
 Ekstremt aktiv og selektiv immobiliseret katalysator til elektrokatalytisk reduktion af kuldioxidKredit:CC0 Public Domain Veldefinerede metalkomplekser med kemisk stabilitet og strukturel afstemning er en lovende klasse af elektrokatalytisk CO 2 reduktion (ECR) katalysatorer, især immobilis
Ekstremt aktiv og selektiv immobiliseret katalysator til elektrokatalytisk reduktion af kuldioxidKredit:CC0 Public Domain Veldefinerede metalkomplekser med kemisk stabilitet og strukturel afstemning er en lovende klasse af elektrokatalytisk CO 2 reduktion (ECR) katalysatorer, især immobilis
- En bold med en vægt på 30 Newton sparkes 2 meter i luften, hvilket arbejde er der gjort?
- Digital til at overhale traditionel annoncering i USA:tracker
- Nu kan din telefon blive en robot, der udfører det kedelige arbejde
- Hvad er formlen til at ændre Kelvin til Fahrenheit?
- Hvad er den længste syd for Zodiac Constellation?
- Hvilken farve er solnedgangen på månen?


