Hvad sker der, når du blander disodiumphosphat med natriumhyrdroxid?
na₂hpo₄ + naoh → na₃po₄ + h₂o
Her er en sammenbrud:
* Disodiumphosphat (Na₂hpo₄) er en svag base, hvilket betyder, at den kan acceptere protoner (H⁺).
* natriumhydroxid (NaOH) er en stærk base, hvilket betyder, at den let donerer hydroxidioner (OH⁻).
* Reaktionen producerer trisodiumphosphat (Na₃po₄) , som er et mere opløseligt fosfatsalt og vand (H₂O) .
I det væsentlige afprotonerer hydroxidionerne fra natriumhydroxid -disodiumphosphatet, hvilket danner det mere basale trisodiumphosphat.
Vigtige noter:
* reaktionen er eksoterm, hvilket betyder, at det frigiver varme.
* Opløsningen øges Efterhånden som reaktionen skrider frem og bliver mere alkalisk.
* Den resulterende opløsning vil indeholde en blanding af fosfationer (Po₄³⁻) og hydroxidioner (OH⁻).
anvendelser:
Denne reaktion bruges i forskellige applikationer, herunder:
* rengøring: Trisodiumphosphat er en almindelig ingrediens i rengøringsprodukter.
* Vandbehandling: Det bruges til at justere vandets pH og til at fjerne tungmetaller.
* fødevareindustri: Trisodiumphosphat bruges som fødevaretilsætningsstof, for eksempel som en stabilisator i forarbejdet ost.
sikkerhed:
Både natriumhydroxid og trisodiumphosphat er kaustiske og kan forårsage hud- og øjenirritation. Håndter altid disse kemikalier med omhu og følg passende sikkerhedsforholdsregler.
 Varme artikler
Varme artikler
-
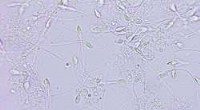 Forskere udvikler en ny clip-on-enhed til smartphones til analyse af sædcellerKredit:Lukasz Pawel Szczepanski, Shutterstock Mandlig infertilitetstest udføres i øjeblikket udelukkende i laboratorier, kræver flere besøg og flere dage for at få et resultat. Det EU-finansierede
Forskere udvikler en ny clip-on-enhed til smartphones til analyse af sædcellerKredit:Lukasz Pawel Szczepanski, Shutterstock Mandlig infertilitetstest udføres i øjeblikket udelukkende i laboratorier, kræver flere besøg og flere dage for at få et resultat. Det EU-finansierede -
 Ny måde at fremstille biomedicinsk udstyr på af silke giver bedre produkter med afstembare kvalite…Råprodukt i form af silkepulver kan nemt opbevares, transporteret, og støbt til forskellige former med overlegne egenskaber i forhold til mange andre materialer, der anvendes i medicinske implantater.
Ny måde at fremstille biomedicinsk udstyr på af silke giver bedre produkter med afstembare kvalite…Råprodukt i form af silkepulver kan nemt opbevares, transporteret, og støbt til forskellige former med overlegne egenskaber i forhold til mange andre materialer, der anvendes i medicinske implantater. -
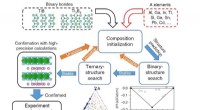 Find en nål i en høstak:Opdagelse af Ti2InB2 til syntetisering af lagdelt TiBMed strategien afbildet, det var muligt at foretage en teoretisk søgning med tusinder af indledende kandidater for endelig at opnå de bedste to MAX -faser for den potentielle syntese af TiB MXenes, so
Find en nål i en høstak:Opdagelse af Ti2InB2 til syntetisering af lagdelt TiBMed strategien afbildet, det var muligt at foretage en teoretisk søgning med tusinder af indledende kandidater for endelig at opnå de bedste to MAX -faser for den potentielle syntese af TiB MXenes, so -
 Ekstremt aktiv og selektiv immobiliseret katalysator til elektrokatalytisk reduktion af kuldioxidKredit:CC0 Public Domain Veldefinerede metalkomplekser med kemisk stabilitet og strukturel afstemning er en lovende klasse af elektrokatalytisk CO 2 reduktion (ECR) katalysatorer, især immobilis
Ekstremt aktiv og selektiv immobiliseret katalysator til elektrokatalytisk reduktion af kuldioxidKredit:CC0 Public Domain Veldefinerede metalkomplekser med kemisk stabilitet og strukturel afstemning er en lovende klasse af elektrokatalytisk CO 2 reduktion (ECR) katalysatorer, især immobilis


