Hvor mange iltmolekyler er der i 9,1 L gas ved STP?
1. Brug den ideelle gaslov:
Den ideelle gaslov siger:PV =NRT
* P =pres (ATM)
* V =volumen (l)
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (k)
2. STP -betingelser:
* Standard temperatur og tryk (STP) er defineret som 0 ° C (273,15 K) og 1 atm.
3. Løs for mol (n):
* Omarranger den ideelle gaslov, der skal løses for N:N =PV / RT
* Tilslut værdierne:n =(1 atm) (9,1 l) / (0,0821 l · atm / mol · k) (273,15 K)
* Beregn:N ≈ 0,406 mol ilt
4. Konverter mol til molekyler:
* Brug Avogadros nummer (6.022 x 10^23 molekyler/mol) til at konvertere mol til molekyler:
* 0,406 mol O2 x (6,022 x 10^23 molekyler/mol) ≈ 2,44 x 10^23 molekyler af ilt
Derfor er der ca. 2,44 x 10^23 iltmolekyler i 9,1 le gas ved stp.
Sidste artikelHvor mange atomer af ilt er der i 300 molekyler CH3CO2H?
Næste artikelEr klor et atom eller molekyle?
 Varme artikler
Varme artikler
-
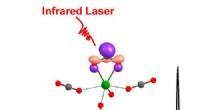 Forskere identificerer overgangsmetal til højeffektiv kuldioxidaktiveringSpektroskopisk identifikation af overgangsmetal M[η 2 -(O, O)C] arter til højeffektiv CO2-aktivering. Kredit:ZHENG Huijun Den atmosfæriske koncentration af kuldioxid (CO 2 ) har været stigende
Forskere identificerer overgangsmetal til højeffektiv kuldioxidaktiveringSpektroskopisk identifikation af overgangsmetal M[η 2 -(O, O)C] arter til højeffektiv CO2-aktivering. Kredit:ZHENG Huijun Den atmosfæriske koncentration af kuldioxid (CO 2 ) har været stigende -
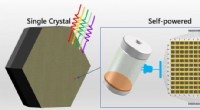 Multi-tommer enkelt-krystallinsk perovskit til selvforsynet integreret kredsløb fotodetektion rappo…Tommerstørrelse perovskit-enkeltkrystaller af høj kvalitet dannet ved at undertrykke faseadskillelsen til applikationer i lysdrevne integrerede kredsløb. Kredit:DICP Perovskitter med flere katione
Multi-tommer enkelt-krystallinsk perovskit til selvforsynet integreret kredsløb fotodetektion rappo…Tommerstørrelse perovskit-enkeltkrystaller af høj kvalitet dannet ved at undertrykke faseadskillelsen til applikationer i lysdrevne integrerede kredsløb. Kredit:DICP Perovskitter med flere katione -
 Verdens første ultralydsbiosensor skabt i AustralienKredit:CC0 Public Domain Evnen til nøjagtigt at overvåge lægemiddelniveauer og biologiske molekyler inde i patienter i realtid har stort set været uhåndgribelig. De fleste af de implanterbare mon
Verdens første ultralydsbiosensor skabt i AustralienKredit:CC0 Public Domain Evnen til nøjagtigt at overvåge lægemiddelniveauer og biologiske molekyler inde i patienter i realtid har stort set været uhåndgribelig. De fleste af de implanterbare mon -
 En ny teknik til at producere billigere og mere effektiv klorFigur 1:Karakterisering af Pt1/CNT-katalysator omfattende atomisk dispergerede Pt?N4-steder på overfladen af CNT. Kredit:UNIST Klor er et af de mest udbredte industrielle kemikalier i verden i d
En ny teknik til at producere billigere og mere effektiv klorFigur 1:Karakterisering af Pt1/CNT-katalysator omfattende atomisk dispergerede Pt?N4-steder på overfladen af CNT. Kredit:UNIST Klor er et af de mest udbredte industrielle kemikalier i verden i d


