Hvorfor er jod er fast og fluordas ved stuetemperatur?
Her er en sammenbrud:
* jod (i₂):
* Jodmolekyler er store og har et betydeligt antal elektroner. Dette fører til stærke London Dispersion Forces (inducerede dipolinducerede dipolinteraktioner) mellem jodmolekyler. Disse kræfter er stærke nok til at holde molekylerne sammen i et fast gitter ved stuetemperatur.
* svage van der Waals Forces er også til stede, men de er svagere sammenlignet med London Dispersion Forces.
* fluor (f₂):
* Fluormolekyler er små og har færre elektroner. Følgelig London Dispersion Forces Mellem fluormolekyler er meget svage.
* Derudover er fluor et meget elektronegativt element, der fører til svage dipol-dipol-interaktioner.
* Disse svage intermolekylære kræfter er ikke stærke nok til at holde fluormolekylerne sammen i en flydende eller fast tilstand ved stuetemperatur, hvilket resulterer i en gasformig tilstand.
Kortfattet:
* stærkere intermolekylære kræfter I jod (på grund af dens størrelse og elektrondensitet) fører til dens faste tilstand ved stuetemperatur.
* svagere intermolekylære kræfter i fluor (på grund af dens lille størrelse og færre elektroner) resulterer i dens gasformige tilstand ved stuetemperatur.
 Varme artikler
Varme artikler
-
 Skræddersyede materialer med ultrahurtige forbindelserNår atomisk tynde lag af to materialer stables og snoes, et heterostruktur-materiale opstår. En ny forbindelse er dannet, næsten øjeblikkeligt, med specielle energitilstande - kendt som interlayer exc
Skræddersyede materialer med ultrahurtige forbindelserNår atomisk tynde lag af to materialer stables og snoes, et heterostruktur-materiale opstår. En ny forbindelse er dannet, næsten øjeblikkeligt, med specielle energitilstande - kendt som interlayer exc -
 Kan fremtidens huse laves af bakterier?Et hus lavet af et plastik-lignende materiale skabt af bakterier i Neel Joshis laboratorium. Kredit:Ruby Wallau/Northeastern University Tænk, hvis vi kunne dyrke en bygning, som koralpolypper dyrk
Kan fremtidens huse laves af bakterier?Et hus lavet af et plastik-lignende materiale skabt af bakterier i Neel Joshis laboratorium. Kredit:Ruby Wallau/Northeastern University Tænk, hvis vi kunne dyrke en bygning, som koralpolypper dyrk -
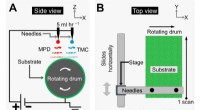 Forskere skaber omvendt osmose-membraner med justerbar tykkelseEn skematisk illustration - både ovenfra og fra siden - af 3-D-udskrivning elektrospray-processen, der blev brugt til at skabe ekstremt glatte tyndfilmskompositmembraner, der blev udviklet i McCutcheo
Forskere skaber omvendt osmose-membraner med justerbar tykkelseEn skematisk illustration - både ovenfra og fra siden - af 3-D-udskrivning elektrospray-processen, der blev brugt til at skabe ekstremt glatte tyndfilmskompositmembraner, der blev udviklet i McCutcheo -
 3-D printede elektroder frigør gassenArkitekterede 3-D elektroder:Håndtering af boblemigrering i gasudviklingsreaktioner ved høje strømtætheder. Kredit:Yat Li. Alkalisk vandelektrolyse er blevet udråbt som en vej til at etablere en b
3-D printede elektroder frigør gassenArkitekterede 3-D elektroder:Håndtering af boblemigrering i gasudviklingsreaktioner ved høje strømtætheder. Kredit:Yat Li. Alkalisk vandelektrolyse er blevet udråbt som en vej til at etablere en b
- Hvordan flyder geotermisk energi af termisk fra varmt til koldt eller varmt?
- Kan man virkelig være dobbeltleddet?
- Kølende mikroprocessorer med carbon nanorør
- Bestræbelser på at masseproducere fleksibel elektronik i nanoskala
- Hvilken klippe udgør skorpen og den øverste mantel?
- Forskel mellem data og konklusion af en undersøgelse


