Hvorfor opbevares kaliumferrocyanid i mørke farvede flasker og holdes væk fra sollys?
* Fotokemisk nedbrydning: Kaliumferrocyanid er følsom over for lys, især ultraviolet (UV) stråling. Eksponering for sollys kan udløse en kemisk reaktion, der nedbryder forbindelsen. Denne nedbrydning resulterer i dannelsen af toksisk cyanidgas (HCN), hvilket kan være ekstremt farligt.
* Dannelse af preussisk blå: Et andet produkt af nedbrydning er preussisk blå, et mørkeblå pigment. Denne formation kan ændre farven og egenskaberne af kaliumferrocyanidopløsningen, hvilket påvirker dens tilsigtede anvendelse.
* sikkerhedsmæssige bekymringer: Frigivelsen af cyanidgas er en stor sikkerhedsfare. Selv små mængder kan være dødelige. Derfor minimerer opbevaring af kaliumferrocyanid i mørke flasker og væk fra sollys risikoen for nedbrydning og potentialet for cyanidforgiftning.
her er en simpel analogi: Tænk på sollys som en kraftfuld energikilde, der kan bryde delikate molekyler fra hinanden. Kaliumferrocyanid er et sådelt delikat molekyle, der er sårbart over for denne energi. Ved at opbevare den i mørke forhindrer vi, at denne energi når den og får den til at bryde sammen.
Ud over at opbevare det i mørke flasker, bør kaliumferrocyanid også opbevares på et køligt, tørt sted væk fra oxidationsmidler og stærke syrer.
Sidste artikelHvad er den kemiske formel for calcium og svovl?
Næste artikelHvorfor opbevares natrium i inert opløsningsmiddel?
 Varme artikler
Varme artikler
-
 Udvikling af ledende og elektrokatalytiske mediatorer i Li-S-batterierFe-MoSe2 @rGO giver en lovende mulighed for at producere en udviklet separatorfunktion til praktiske Li-S-batterier med høj energidensitet. Fe-MoSe2 @rGO-PP udviser fremragende cykelstabilitet under m
Udvikling af ledende og elektrokatalytiske mediatorer i Li-S-batterierFe-MoSe2 @rGO giver en lovende mulighed for at producere en udviklet separatorfunktion til praktiske Li-S-batterier med høj energidensitet. Fe-MoSe2 @rGO-PP udviser fremragende cykelstabilitet under m -
 Bekræftelse af stamtavlen for urankuber fra Nazitysklands mislykkede atomprogramRobertson med PNNLs terning, som er i et beskyttende etui. Kredit:Andrea Starr/PNNL Under Anden Verdenskrig, Nazityskland og USA var kapløb om at udvikle nuklear teknologi. Før Tyskland kunne lykk
Bekræftelse af stamtavlen for urankuber fra Nazitysklands mislykkede atomprogramRobertson med PNNLs terning, som er i et beskyttende etui. Kredit:Andrea Starr/PNNL Under Anden Verdenskrig, Nazityskland og USA var kapløb om at udvikle nuklear teknologi. Før Tyskland kunne lykk -
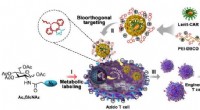 Forskere udvikler kunstige kemiske receptorer til at hjælpe viral transduktion til T-celleteknikAnvendelse af kunstig kemisk receptor i CAR-konstrueret T-cellefremstilling og immunterapi af tumor. Kredit:CAI Lintao Konstrueret T-celle immunterapi, såsom kimærisk antigenreceptor T-celle (CAR-
Forskere udvikler kunstige kemiske receptorer til at hjælpe viral transduktion til T-celleteknikAnvendelse af kunstig kemisk receptor i CAR-konstrueret T-cellefremstilling og immunterapi af tumor. Kredit:CAI Lintao Konstrueret T-celle immunterapi, såsom kimærisk antigenreceptor T-celle (CAR- -
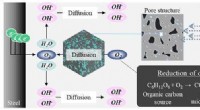 Korrosionsbestandighed af stålstænger i beton, når de blandes med aerobe mikroorganismerEt skematisk billede af indtrængen af ilt i porestrukturen og reduktion af opløst ilt af aerobe mikroorganismer i poreopløsning. Kredit:Ehime University Opløst oxygen i poreopløsning er ofte en
Korrosionsbestandighed af stålstænger i beton, når de blandes med aerobe mikroorganismerEt skematisk billede af indtrængen af ilt i porestrukturen og reduktion af opløst ilt af aerobe mikroorganismer i poreopløsning. Kredit:Ehime University Opløst oxygen i poreopløsning er ofte en


