Hvad sker der, når du opvarmer NaCl MGSO4 og H2O?
1. Fordampning af vand:
* lave temperaturer: Hvis du opvarmer blandingen forsigtigt, fordamper vandet simpelthen. Dette efterlader en solid blanding af NaCl og MGSO 4 .
* Højere temperaturer: Hvis du opvarmer blandingen til en højere temperatur (over 100 ° C), får du stadig vandfordampning, men du begynder også at se nogle ændringer i de faste komponenter.
2. Ændringer i de faste komponenter:
* magnesiumsulfat: MGSO 4 er et hydreret salt, hvilket betyder, at det har vandmolekyler bundet inden for sin krystalstruktur. Efter opvarmning frigives dette vandvand som damp. Denne proces kaldes dehydrering.
* MGSO 4 · 7H 2 O (heptahydrat) mister sit vand af hydratisering i trin og bliver til sidst vandfri MGSO 4 .
* Den nøjagtige temperatur, hvormed dehydrering forekommer, afhænger af den specifikke hydratform af MGSO 4 .
* natriumchlorid: NaCl har ikke vand af hydratisering og vil forblive som et fast stof, selv ved relativt høje temperaturer. Det kan dog smelte ved meget høje temperaturer (ca. 801 ° C).
3. Potentielle reaktioner:
* Ved meget høje temperaturer: Det er muligt, at den vandfri MGSO 4 Kunne reagere med NaCl, men det vil sandsynligvis ikke ske ved temperaturer, som du typisk vil bruge i en laboratorieindstilling.
Kortfattet:
* Opvarmning af blandingen vil for det meste resultere i vandfordampning, hvilket efterlader dig med en solid blanding af NaCl og Mgso 4 .
* Opvarmning til højere temperaturer vil dehydrere MGSO 4 , potentielt føre til dannelsen af vandfri MGSO 4 . NaCl vil forblive som et solidt.
Det er vigtigt at bemærke, at det nøjagtige resultat afhænger af de specifikke betingelser, og du kan se en kombination af ovenstående effekter. Hvis du udfører et eksperiment, er det vigtigt at være opmærksom på de farer, der er forbundet med opvarmningskemikalier.
 Varme artikler
Varme artikler
-
 At stryge et puslespilAlison Butler. Kredit: Matt Perko Alison Butler har aldrig mødt den canadiske kemiker og filantrop Alfred Bader, men de har noget vigtigt til fælles. Harvard-uddannede Bader anses af American Che
At stryge et puslespilAlison Butler. Kredit: Matt Perko Alison Butler har aldrig mødt den canadiske kemiker og filantrop Alfred Bader, men de har noget vigtigt til fælles. Harvard-uddannede Bader anses af American Che -
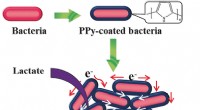 Ledende skal for bakterierKredit:Wiley Under anaerobe forhold, visse bakterier kan producere elektricitet. Denne adfærd kan udnyttes i mikrobielle brændselsceller, med særligt fokus på spildevandsbehandlingsordninger. Et s
Ledende skal for bakterierKredit:Wiley Under anaerobe forhold, visse bakterier kan producere elektricitet. Denne adfærd kan udnyttes i mikrobielle brændselsceller, med særligt fokus på spildevandsbehandlingsordninger. Et s -
 Ny udvikling inden for kontaktlinser til rød-grøn farveblindhed ved hjælp af simpelt farvestofKredit:University of Birmingham Forskere ved University of Birmingham har udviklet en kontaktlinse, der kan hjælpe mennesker med farveblindhed blot ved at bruge et billigt farvestof, ifølge forskn
Ny udvikling inden for kontaktlinser til rød-grøn farveblindhed ved hjælp af simpelt farvestofKredit:University of Birmingham Forskere ved University of Birmingham har udviklet en kontaktlinse, der kan hjælpe mennesker med farveblindhed blot ved at bruge et billigt farvestof, ifølge forskn -
 Blåt pigment fra manipulerede svampe kan hjælpe med at gøre tekstilindustrien grønLederforsker Aindrila Mukhopadhyay har et hætteglas med rensede indigoidine krystaller. Kredit:Marilyn Chung/Berkeley Lab Tit, resultaterne af grundlæggende videnskabelig forskning er mange skridt
Blåt pigment fra manipulerede svampe kan hjælpe med at gøre tekstilindustrien grønLederforsker Aindrila Mukhopadhyay har et hætteglas med rensede indigoidine krystaller. Kredit:Marilyn Chung/Berkeley Lab Tit, resultaterne af grundlæggende videnskabelig forskning er mange skridt
- Hvad sker der, når en sten rammer vandet
- Hvordan aktiemarkedsineffektivitet kan påvirke realøkonomien
- Hvor findes de yngste klipper på havbunden typisk?
- Afsløring af køretøjer og teknologier til fremtidig rumtransport
- Hvad kan hajer lære os om vores hjerter?
- Forklar hvordan alle levende ting er opbygget af nogle få elementer?


