Er nitrat et eksempel på ion, der danner resonansstrukturer?
Her er hvorfor:
* struktur: Nitrationen har et nitrogenatom bundet til tre iltatomer. Det ene iltatom er enkeltvis bundet til nitrogenet, mens de to andre iltatomer er dobbelt bundet.
* Elektrondelokalisering: Det ensomme par på det enkeltbundne ilt kan delokalisere og danne en dobbeltbinding med nitrogenet. Denne proces kan forekomme med hvert af iltatomerne.
* Resonansstrukturer: Denne delokalisering af elektroner resulterer i flere ækvivalente Lewis -strukturer, kaldet resonansstrukturer. Disse strukturer er ikke reelle, men repræsenterer snarere den gennemsnitlige fordeling af elektroner inden for ion.
Den sande struktur af nitrationen er en hybrid af dens resonansstrukturer, med den negative ladning spredt jævnt over alle tre iltatomer. Denne delokalisering af elektroner gør nitrationen meget stabil.
 Varme artikler
Varme artikler
-
 Oprydning af brintoverilteproduktionSolugens proprietære proces til fremstilling af hydrogenperoxid bruger modificerede enzymer og billige forbindelser som sukker. Det bliver i øjeblikket brugt i to pilotanlæg, der producerer mere end 1
Oprydning af brintoverilteproduktionSolugens proprietære proces til fremstilling af hydrogenperoxid bruger modificerede enzymer og billige forbindelser som sukker. Det bliver i øjeblikket brugt i to pilotanlæg, der producerer mere end 1 -
 Lab-lavet hormon kan afsløre planters hemmelige livEn syntetisk version af auxin og dets proteinreceptor (lyseblå) lægger sig sammen, skabe et konstrueret par, der opfører sig ligesom det naturlige. Kredit:Keiko Torii/University of Washington/Howard H
Lab-lavet hormon kan afsløre planters hemmelige livEn syntetisk version af auxin og dets proteinreceptor (lyseblå) lægger sig sammen, skabe et konstrueret par, der opfører sig ligesom det naturlige. Kredit:Keiko Torii/University of Washington/Howard H -
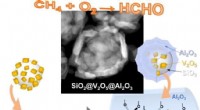 Forskere finder nye måder at udnytte spildt metan påSkematisk billede, der viser SiO 2 @V 2 O 5 @Al 2 O 3 core@shell nanostrukturer. Kredit:UNIST Den primære komponent i naturgas, metan, er i sig selv en potent drivhusgas. En nylig unders
Forskere finder nye måder at udnytte spildt metan påSkematisk billede, der viser SiO 2 @V 2 O 5 @Al 2 O 3 core@shell nanostrukturer. Kredit:UNIST Den primære komponent i naturgas, metan, er i sig selv en potent drivhusgas. En nylig unders -
 Video:Hvorfor hader nogle mennesker koriander?Kredit:The American Chemical Society Koriander er et populært krydderi, tilføjer smag til tacos og nudelretter over hele kloden. Men for nogle mennesker, det smager bare af sæbe. Hvad sker der he
Video:Hvorfor hader nogle mennesker koriander?Kredit:The American Chemical Society Koriander er et populært krydderi, tilføjer smag til tacos og nudelretter over hele kloden. Men for nogle mennesker, det smager bare af sæbe. Hvad sker der he
- Hvad vokser planter bedst i syre eller alkali?
- Hvor lang tid tager det solvinden at nå jorden?
- Billeder af usynlige huller på celler kan sætte gang i forskningen
- Er solenergi bredt accepteret i dag?
- Hvilke farver kan en stjerne udstille på nattehimlen?
- Temperaturstyret vogn skal vises i butikker til afhentning af dagligvarer


