Hvorfor har heptan et højere kogepunkt end pentan?
* molekylær størrelse: Heptan (C7H16) har en længere kulstofkæde og er derfor større end pentan (C5H12).
* overfladeareal: Den større størrelse af heptan betyder, at den har et større overfladeareal.
* van der Waals Forces: Større molekyler med større overfladeareal har stærkere London -spredningskræfter (en type van der Waals Force). Disse kræfter stammer fra midlertidige udsving i elektronfordeling inden for molekylet, hvilket skaber midlertidige dipoler, der tiltrækker nabolande molekyler.
* øget energi, der kræves for at overvinde tiltrækning: Stærkere intermolekylære kræfter kræver mere energi til at overvinde, hvilket resulterer i et højere kogepunkt.
Kortfattet: Den større størrelse og større overfladeareal af heptan fører til stærkere spredningskræfter i London, som kræver mere energi for at bryde, hvilket resulterer i et højere kogepunkt sammenlignet med pentan.
 Varme artikler
Varme artikler
-
 Grøn brint:Hvorfor forbedres visse katalysatorer i drift?Mineralet erytrit består af kobolt- og arsenoxider med en molekylformel på (Co3(AsO4)2∙8H2O). Det er et modelsystem for en gruppe katalysatormaterialer, som forbedres med tiden. Kredit:CC BY 3.0, via
Grøn brint:Hvorfor forbedres visse katalysatorer i drift?Mineralet erytrit består af kobolt- og arsenoxider med en molekylformel på (Co3(AsO4)2∙8H2O). Det er et modelsystem for en gruppe katalysatormaterialer, som forbedres med tiden. Kredit:CC BY 3.0, via -
 Ingeniører gør et lovende materiale stabilt nok til brug i solcellerBare det at tilføje et omfangsrigt molekyle til overfladen af en perovskit kan endelig gøre materialet stabilt nok til at blive inkorporeret i solpaneler. Kredit:Purdue University illustration/Enzhe
Ingeniører gør et lovende materiale stabilt nok til brug i solcellerBare det at tilføje et omfangsrigt molekyle til overfladen af en perovskit kan endelig gøre materialet stabilt nok til at blive inkorporeret i solpaneler. Kredit:Purdue University illustration/Enzhe -
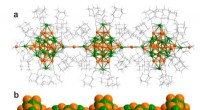 Teknik til fremstilling af funktionelle materialer baseret på polymerer af metalklyngerFigur a:Visualisering af en lineær polymer af 34-atom sølv-guldklyngerne med metal-metalbinding mellem klyngerne i vandret retning (guld:orange, sølv:grøn, ligandmolekyler (ethynyladamantan) er vist m
Teknik til fremstilling af funktionelle materialer baseret på polymerer af metalklyngerFigur a:Visualisering af en lineær polymer af 34-atom sølv-guldklyngerne med metal-metalbinding mellem klyngerne i vandret retning (guld:orange, sølv:grøn, ligandmolekyler (ethynyladamantan) er vist m -
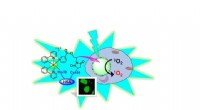 Blot at skinne lys på dinosaurmetalforbindelse dræber kræftcellerIridium med sin organiske pels, som er koblet til proteinet albumin (HSA). Sammen kommer de ind i kræftceller og leverer iridium-fotosensibilisatoren til kernen. Ved bestråling med blåt lys, iridium l
Blot at skinne lys på dinosaurmetalforbindelse dræber kræftcellerIridium med sin organiske pels, som er koblet til proteinet albumin (HSA). Sammen kommer de ind i kræftceller og leverer iridium-fotosensibilisatoren til kernen. Ved bestråling med blåt lys, iridium l
- Kunne AI-drevet objektgenkendelsesteknologi hjælpe med at løse hvedesygdomme?
- Kemisk vej til elektroniske enheder i grafen
- Naturlige årsager er den vigtigste drivkraft for ændringer i Athabasca Delta oversvømmelsesmønst…
- Oprensning af olie ved hjælp af magneter
- One-pot teknik skaber strukturer med potentiale for mere effektiv fremstilling og energilagring
- Hvad er eksempler på samarbejde og konkurrence mellem arter i bjergene?


