Har klor et højere kogepunkt end jod?
Her er hvorfor:
* Intermolekylære kræfter: Styrken af intermolekylære kræfter mellem molekyler bestemmer kogepunktet. Jod har stærkere London -spredningskræfter (en type van der Waals -kraft) end klor på grund af dets større størrelse og større antal elektroner.
* størrelse og polariserbarhed: Jodatomer er meget større end kloratomer. Dette betyder, at de er mere polariserbare, hvilket betyder, at deres elektronskyer lettere kan forvrænges. Større polariserbarhed fører til stærkere London -spredningskræfter.
kogepunkter:
* klor (CL2): -34,04 ° C.
* jod (i2): 184,3 ° C.
Derfor kræver jodens stærkere intermolekylære kræfter mere energi til at overvinde, hvilket resulterer i et højere kogepunkt.
 Varme artikler
Varme artikler
-
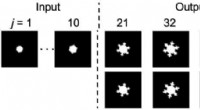 Ny strategi sætter udviklingen af mikroskopiske strukturer i gangIngeniører ved Rice University og Lawrence Livermore National Laboratory bruger neurale netværk til at fremskynde forudsigelsen af, hvordan mikrostrukturer af materialer udvikler sig. Dette eksempel f
Ny strategi sætter udviklingen af mikroskopiske strukturer i gangIngeniører ved Rice University og Lawrence Livermore National Laboratory bruger neurale netværk til at fremskynde forudsigelsen af, hvordan mikrostrukturer af materialer udvikler sig. Dette eksempel f -
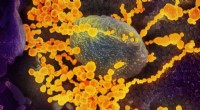 Forskere viser, at selvsteriliserende polymerer virker mod SARS-CoV-2Dette scanningselektronmikroskopbillede viser SARS-CoV-2 (runde guldobjekter), der dukker op fra overfladen af celler dyrket i laboratoriet. Kredit:NIAID-RML Forskere fra North Carolina State Un
Forskere viser, at selvsteriliserende polymerer virker mod SARS-CoV-2Dette scanningselektronmikroskopbillede viser SARS-CoV-2 (runde guldobjekter), der dukker op fra overfladen af celler dyrket i laboratoriet. Kredit:NIAID-RML Forskere fra North Carolina State Un -
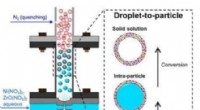 Nanoshell-katalysatorer gør drivhusgasser til nyttige kemikalierEt diagram, der viser, hvordan den nye nikkelbaserede katalysator er skabt ved hjælp af den unikke flammeaerosolproces, der er skabt i Mark Swiharts laboratorium. Kredit:University at Buffalo Et bi
Nanoshell-katalysatorer gør drivhusgasser til nyttige kemikalierEt diagram, der viser, hvordan den nye nikkelbaserede katalysator er skabt ved hjælp af den unikke flammeaerosolproces, der er skabt i Mark Swiharts laboratorium. Kredit:University at Buffalo Et bi -
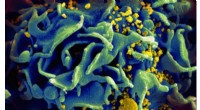 Fullerenforbindelser slår virusinfektioner som HIV og HSV udMikroskopisk billede af en HIV-inficeret T-celle. Kredit:NIAID Forskere fra Skoltech Center for Energividenskab og Teknologi og Institute of Problems of Chemical Physics of RAS har i samarbejde me
Fullerenforbindelser slår virusinfektioner som HIV og HSV udMikroskopisk billede af en HIV-inficeret T-celle. Kredit:NIAID Forskere fra Skoltech Center for Energividenskab og Teknologi og Institute of Problems of Chemical Physics of RAS har i samarbejde me
- Nyligt transskriberet krønike beskriver ekstreme vejrhændelser, der ramte Bristol for 400 år side…
- Hvorfor dyrkning af afgrøder til mad frem for energi i Midtvesten kan hjælpe med at afbøde klimaæ…
- EU-lovgivere pålægger en enkelt oplader til alle smartphones
- Hvem er skyld i havaffald?
- Spitzer studerer en stjernelegeplads med en lang historie
- Kontrol af vejtrafik inde i celler med nano GPS


