Hvorfor er siliciumdioxid et fast stof?
* kovalent binding: Hvert siliciumatom danner fire kovalente bindinger med fire iltatomer. Disse obligationer er meget stærke, hvilket kræver en masse energi til at bryde.
* gigantisk netværksstruktur: Silicium- og iltatomerne er forbundet i et kontinuerligt tredimensionelt netværk, hvor hvert siliciumatom er bundet til fire iltatomer, og hvert iltatom er bundet til to siliciumatomer. Dette skaber en stiv og stabil struktur.
Her er en forenklet forklaring:
Forestil dig siliciumdioxid som et kæmpe sammenkoblet puslespil. Stykkerne (silicium- og iltatomer) holdes sammen af stærke lim (kovalente bindinger). Dette gør strukturen meget stiv og vanskelig at bryde fra hinanden, hvilket resulterer i et solidt.
I modsætning:
* Stoffer med svage intermolekylære kræfter (som vand) er væsker ved stuetemperatur, fordi kræfterne, der holder molekylerne sammen, let overvindes.
* Stoffer med svage bindinger (som gasser) har meget lidt tiltrækning mellem deres molekyler, så de kan bevæge sig frit.
Derfor er de stærke kovalente bindinger og den gigantiske netværksstruktur i siliciumdioxid ansvarlige for dets faste tilstand ved stuetemperatur.
 Varme artikler
Varme artikler
-
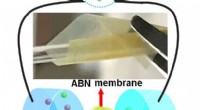 Membran inspireret af knogler og brusk producerer effektivt elektricitet fra saltvandDette diagram viser bio-inspirerede nanokompositmembraner til effektiv høst af blå energi. Kredit:Chen et al. Inspireret af membraner i levende organismers kropsvæv, forskere har kombineret aramid
Membran inspireret af knogler og brusk producerer effektivt elektricitet fra saltvandDette diagram viser bio-inspirerede nanokompositmembraner til effektiv høst af blå energi. Kredit:Chen et al. Inspireret af membraner i levende organismers kropsvæv, forskere har kombineret aramid -
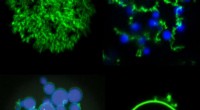 Varme og lys skaber nye biokompatible mikropartiklerBlandinger af POPer (grøn) og ELPer (blå) kan bruges til at skabe en række nye mikropartikelarkitekturer, herunder (med uret fra øverst til venstre) porøse partikler, frugt-på-vin-netværk, enkelte hul
Varme og lys skaber nye biokompatible mikropartiklerBlandinger af POPer (grøn) og ELPer (blå) kan bruges til at skabe en række nye mikropartikelarkitekturer, herunder (med uret fra øverst til venstre) porøse partikler, frugt-på-vin-netværk, enkelte hul -
 Et klæbrigt emne:At studere skaldyr til avancerede klæbemidlerJonathan Wilker, professor i uorganisk kemi, studerer skaldyr for at udvikle klæbemidler, der er mere bæredygtige og stærkere, og arbejde i en bredere vifte af miljøer end nuværende klæbemidler. Kredi
Et klæbrigt emne:At studere skaldyr til avancerede klæbemidlerJonathan Wilker, professor i uorganisk kemi, studerer skaldyr for at udvikle klæbemidler, der er mere bæredygtige og stærkere, og arbejde i en bredere vifte af miljøer end nuværende klæbemidler. Kredi -
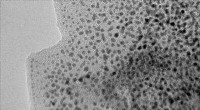 Forskere udvikler nyt materiale til længerevarende brændselscellerTransmissionselektronmikrofotografi af grafen dekoreret med platinnanopartikler. De mørke pletter er platinnanopartiklerne, og det grå ark, de ligger på, er grafenunderstøtningsmaterialet. Kredit:Patr
Forskere udvikler nyt materiale til længerevarende brændselscellerTransmissionselektronmikrofotografi af grafen dekoreret med platinnanopartikler. De mørke pletter er platinnanopartiklerne, og det grå ark, de ligger på, er grafenunderstøtningsmaterialet. Kredit:Patr
- Hvordan begynder udskiftning i DNA?
- Drone bruges til at hjælpe med 3-D-genindspilning af japansk interneringslejr
- 5 eksempler på stoffer og eksempelblandinger?
- Hvorfor forlod NASA spejle på månen?
- USA kan blive i Paris klimaaftale, med forbehold
- NMR bekræfter molekylære switches bevarer funktion i 2-D-array


