Hvad er reaktion mellem sølvchlorid og ammoniak?
1. Dannelse af diamminerilver (i) ion:
* AGCL, et hvidt fast stof, er uopløseligt i vand.
* Når ammoniak tilsættes, reagerer det med de sølvioner (AG⁺), der er til stede i den faste AGCL.
* To ammoniakmolekyler koordinerer med hver sølvion, der danner diamminerilver (i) ion , [AG (NH₃) ₂] ⁺. Denne komplekse ion er opløselig i vand.
2. Den samlede reaktion:
Den samlede reaktion kan repræsenteres som følger:
`` `
AGCL (S) + 2 NH₃ (aq) ⇌ [AG (NH₃) ₂] ⁺ (aq) + cl⁻ (aq)
`` `
Forklaring:
* Reaktionen er en ligevægtsreaktion, hvilket betyder, at den kan fortsætte i begge retninger.
* Tilsætningen af ammoniak driver reaktionen til højre og favoriserer dannelsen af diamminerilver (I) ion- og chloridioner.
* Opløseligheden af AgCl stiger i nærvær af ammoniak på grund af dannelsen af det opløselige kompleks ion.
Nøglepunkter:
* Diamminerilver (i) -ionen er en farveløs kompleks ion.
* Denne reaktion bruges i analytisk kemi til at opløse sølvchloridudfældning og til at adskille sølv fra andre metaller.
* Reaktionen er reversibel, og tilsætning af overskydende syre (f.eks. Salpetersyre) kan vende reaktionen, hvilket forårsager udfældning af sølvchlorid igen.
Kortfattet:
Reaktionen mellem sølvchlorid og ammoniak resulterer i dannelsen af den opløselige diamminerilver (I) ion, hvilket fører til opløsning af sølvchloridforfærningen.
Sidste artikelHvilket stof fungerer et opløsningsmiddel i tinkturjod?
Næste artikelHvad er statssymbolet for natriumchloridopløsning?
 Varme artikler
Varme artikler
-
 Hydrogel baner vejen for biomedicinsk gennembrudDr Behnam Akhavan, Universitetet i Sydney. Kredit:University of Sydney Udgivet i Avancerede funktionelle materialer , et team af biomedicinske ingeniører fra University of Sydney har udviklet en
Hydrogel baner vejen for biomedicinsk gennembrudDr Behnam Akhavan, Universitetet i Sydney. Kredit:University of Sydney Udgivet i Avancerede funktionelle materialer , et team af biomedicinske ingeniører fra University of Sydney har udviklet en -
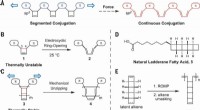 Ultralydsvibrationer tvinger en polymer til at være en halvlederDesign af mekanisk kemisk frembragt konjugeret polymer. (A) Isolerende CBE -mekanoforer forbundet med π -systemer, designet til at omarrangere til kontinuerligt forlænget konjugering under kraft. (B)
Ultralydsvibrationer tvinger en polymer til at være en halvlederDesign af mekanisk kemisk frembragt konjugeret polymer. (A) Isolerende CBE -mekanoforer forbundet med π -systemer, designet til at omarrangere til kontinuerligt forlænget konjugering under kraft. (B) -
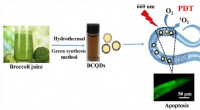 Nem model med høj gennemstrømning til evaluering af effektiviteten af fotodynamisk middelNem model med høj kapacitet til at evaluere effektiviteten af fotodynamisk middel. Kredit:Shereen M. El-Sherbiny For nylig leverede forskere ledet af prof. Huang Qing ved Hefei Institutes of Phys
Nem model med høj gennemstrømning til evaluering af effektiviteten af fotodynamisk middelNem model med høj kapacitet til at evaluere effektiviteten af fotodynamisk middel. Kredit:Shereen M. El-Sherbiny For nylig leverede forskere ledet af prof. Huang Qing ved Hefei Institutes of Phys -
 Spinding af højstyrke polymer nanofibreRamesh Shrestha, Maarten de Boer, og Sheng Shen har transformeret polymerer fra bløde og termisk isolerende materialer til et ultra-stærkt og termisk ledende materiale. Kredit:College of Engineering,
Spinding af højstyrke polymer nanofibreRamesh Shrestha, Maarten de Boer, og Sheng Shen har transformeret polymerer fra bløde og termisk isolerende materialer til et ultra-stærkt og termisk ledende materiale. Kredit:College of Engineering,
- Aktiviteter i femte klasse om styrke og bevægelse
- Fra sommerfuglevinger til pengesedler - hvordan naturens farver kunne reducere banksvindel
- Surrey udvikler ny superkatalysator til at genbruge kuldioxid og metan
- Hvor kommer pollen ind i den kvindelige del af en plante?
- Hvorfor ritualer har været afgørende for mennesker gennem historien - og hvorfor vi stadig har bru…
- Undersøgelser tyder på, at mange konflikter kunne undgås med mere overvejelse


