Hvordan kan der dannes et atom mere end en kovalent binding?
* Valenselektroner: Atomer har elektroner i deres yderste skal kaldet valenselektroner. Disse elektroner er involveret i kemisk binding.
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med otte valenselektroner (undtagen for brint og helium, som har brug for to). Dette er kendt som Octet -reglen.
* Flere obligationer: For at opfylde octetreglen kan nogle atomer dele mere end et par elektroner med andre atomer. Dette skaber flere kovalente obligationer:
* Dobbeltbinding: To par elektroner deles (repræsenteret af to linjer i en Lewis -struktur).
* Triple Bond: Tre par elektroner deles (repræsenteret af tre linjer i en Lewis -struktur).
Eksempel:
* carbon (c): Carbon har fire valenselektroner. For at opnå en stabil oktet kan den danne fire enkelt kovalente bindinger (som i metan, CH4). Det kan også danne dobbeltbindinger (som i ethylen, C2H4) eller tredobbelt bindinger (som i acetylen, C2H2).
Faktorer, der påvirker antallet af kovalente obligationer:
* Antal valenselektroner: Jo mere valenselektroner et atom har, jo flere bindinger kan det potentielt dannes.
* Elektronegativitet: Elektronegativiteten af et atom (dens evne til at tiltrække elektroner) kan påvirke den type binding, den danner.
* atomstørrelse: Mindre atomer har en tendens til at danne flere bindinger på grund af tættere nærhed af deres valenselektroner.
Kortfattet: Atomer kan danne flere kovalente bindinger ved at dele flere par elektroner for at opnå en stabil elektronkonfiguration og tilfredsstille Octet -reglen.
Sidste artikelHvor mange iltatomer er i 1 molekyle CA OH 2?
Næste artikelI hvilke områder er kemisk forvitring langsom?
 Varme artikler
Varme artikler
-
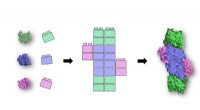 Livets Lego:Dybt dyk ned i proteiners 3D-strukturer afslører vigtige byggestenRutgers-forskere identificerede et lille sæt simple proteinbyggesten (til venstre), der sandsynligvis eksisterede på de tidligste stadier af livets historie. Over milliarder af år, disse livets legos
Livets Lego:Dybt dyk ned i proteiners 3D-strukturer afslører vigtige byggestenRutgers-forskere identificerede et lille sæt simple proteinbyggesten (til venstre), der sandsynligvis eksisterede på de tidligste stadier af livets historie. Over milliarder af år, disse livets legos -
 Forskere eliminerer lægemiddelbivirkninger ved at manipulere molekylær chiralitetDr. Jeffery Huang Zhifeng, Lektor ved Institut for Fysik ved HKBU, har udviklet en ny tilgang til at manipulere lægemiddelmolekylets chiralitet. Kredit:Hong Kong Baptist University Forskere fra Ho
Forskere eliminerer lægemiddelbivirkninger ved at manipulere molekylær chiralitetDr. Jeffery Huang Zhifeng, Lektor ved Institut for Fysik ved HKBU, har udviklet en ny tilgang til at manipulere lægemiddelmolekylets chiralitet. Kredit:Hong Kong Baptist University Forskere fra Ho -
 Enkel vandtest kunne forhindre lammende knoglesygdomDen enkle test skifter farve fra lilla til blå, når fluorindholdet er for højt. Kredit:University of Bath En enkel farveændrende test for at påvise fluor i drikkevand, udtænkt af forskere ved Univ
Enkel vandtest kunne forhindre lammende knoglesygdomDen enkle test skifter farve fra lilla til blå, når fluorindholdet er for højt. Kredit:University of Bath En enkel farveændrende test for at påvise fluor i drikkevand, udtænkt af forskere ved Univ -
 E-næse opsnuser blandinger af flygtige organiske forbindelserEn e-næse MOF-baseret sensor skelner præcist mellem o-xylen, m-xylen og p-xylen fra blandinger. Kredit:Peng Qin Da malingfortynder, blæk og klæbemidler tørrer, kan de frigive flygtige organiske for
E-næse opsnuser blandinger af flygtige organiske forbindelserEn e-næse MOF-baseret sensor skelner præcist mellem o-xylen, m-xylen og p-xylen fra blandinger. Kredit:Peng Qin Da malingfortynder, blæk og klæbemidler tørrer, kan de frigive flygtige organiske for
- Her kommer solen på førstegangsbilleder
- Når verden ikke er nok – hvordan finder man en anden planet at leve på
- Neutrale atomer af neonatomnummer 10 har de samme elektroner som hver hvad undtagen?
- Hvilken stødende rock indeholder den største mængde kvarts?
- Hvorfor tid en operatør i kvantemekanik?
- Hvad bruger forskere til at beskrive den måde, energi flyder gennem et økosystem?


