Hvad er den kemiske reaktion af kaliumdichromat med salpetersyre?
1. Med fortyndet salpetersyre:
* Reaktionen er primært en syre-base-reaktion.
* Dichromate -ion (cr₂o₇²⁻) fungerer som en svag base og reagerer med salpetersyre for at danne kromsyre (H₂cro₄).
* Reaktionen kan repræsenteres som:
`` `
K₂cr₂o₇ + 2 hno₃ → 2 kno₃ + h₂cro₄
`` `
* Krominsyren er ustabil og nedbrydes let i vand og kromtrioxid (CRO₃):
`` `
H₂cro₄ → H₂O + cro₃
`` `
* Den samlede reaktion kan skrives som:
`` `
K₂cr₂o₇ + 2 hno₃ → 2 kno₃ + h₂o + cro₃
`` `
2. Med koncentreret salpetersyre:
* I dette tilfælde er reaktionen mere kompleks og involverer oxidation.
* Koncentreret salpetersyre fungerer som en stærk oxidation, der oxideres dichromationen.
* Reaktionen producerer kromtrioxid (CRO₃), nitrogendioxid (NO₂) og vand.
`` `
K₂cr₂o₇ + 4 hno₃ → 2 kno₃ + 2 cro₃ + 2 no₂ + 2 h₂o
`` `
Vigtige noter:
* Reaktionen med koncentreret salpetersyre er meget eksoterm og kan være farlig.
* Kaliumdikromat- og kromforbindelser er giftige og kræftfremkaldende. Håndter dem med forsigtighed og bær altid passende sikkerhedsudstyr.
* Reaktionen er også følsom over for temperatur og koncentration.
Fortæl mig, hvis du har andre spørgsmål.
 Varme artikler
Varme artikler
-
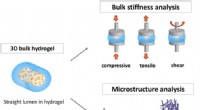 Semi-fleksibel modelbaseret analyse af celleadhæsion til hydrogelerSkematisk repræsentation af metoder til karakterisering af hydrogels fysiske egenskaber:hydrogels bulkstivhed og kædefleksibilitet i viskoelastiske netværk gennem den semi-fleksible model. Kredit: Vid
Semi-fleksibel modelbaseret analyse af celleadhæsion til hydrogelerSkematisk repræsentation af metoder til karakterisering af hydrogels fysiske egenskaber:hydrogels bulkstivhed og kædefleksibilitet i viskoelastiske netværk gennem den semi-fleksible model. Kredit: Vid -
 Muslingeskals-inspireret sukkerskjold beskytter materialer i fjendtlige miljøerSEM A og STEM B tværsnitsbillede, der viser den 5-lags nanokompositstruktur med skiftevis silica og kønrøg efter varmebehandling ved mere end 800 °C. B HAADF-billede og intensitetsprofiler for kulstof
Muslingeskals-inspireret sukkerskjold beskytter materialer i fjendtlige miljøerSEM A og STEM B tværsnitsbillede, der viser den 5-lags nanokompositstruktur med skiftevis silica og kønrøg efter varmebehandling ved mere end 800 °C. B HAADF-billede og intensitetsprofiler for kulstof -
 Video:Kan Google hjælpe dig med at få pletterne ud?Kredit:The American Chemical Society Plettet din skjorte, men har du ikke tid til en spin-cyklus? Din første impuls er sandsynligvis at piske din telefon ud og begynde at google. Men hvor pålid
Video:Kan Google hjælpe dig med at få pletterne ud?Kredit:The American Chemical Society Plettet din skjorte, men har du ikke tid til en spin-cyklus? Din første impuls er sandsynligvis at piske din telefon ud og begynde at google. Men hvor pålid -
 Ny bøjelig smartphone-teknologi kan bruge overvågning til at redde patienters livPurdue University-forskere arbejder på at bruge en ny polymerfilm, som kunne gøre smartphones mere bøjelige, at skabe skræddersyede sensorer, der ikke-invasivt kunne overvåge glukoseniveauer, hjertefr
Ny bøjelig smartphone-teknologi kan bruge overvågning til at redde patienters livPurdue University-forskere arbejder på at bruge en ny polymerfilm, som kunne gøre smartphones mere bøjelige, at skabe skræddersyede sensorer, der ikke-invasivt kunne overvåge glukoseniveauer, hjertefr
- Hvad sker der i en syrebasreaktion i henhold til Arrhenius -definitionen?
- Hvad er nødvendigt for nøjagtigt og fuldstændigt at beskrive et objekts bevægelse?
- Hvad er formålet med transport til proteiner?
- Japan afventer kapsler retur med asteroide jordprøver
- Hvem troede, at et atom består af udelelig partikel?
- Hvilket er ikke et træk ved Jorden?


