Semi-fleksibel modelbaseret analyse af celleadhæsion til hydrogeler
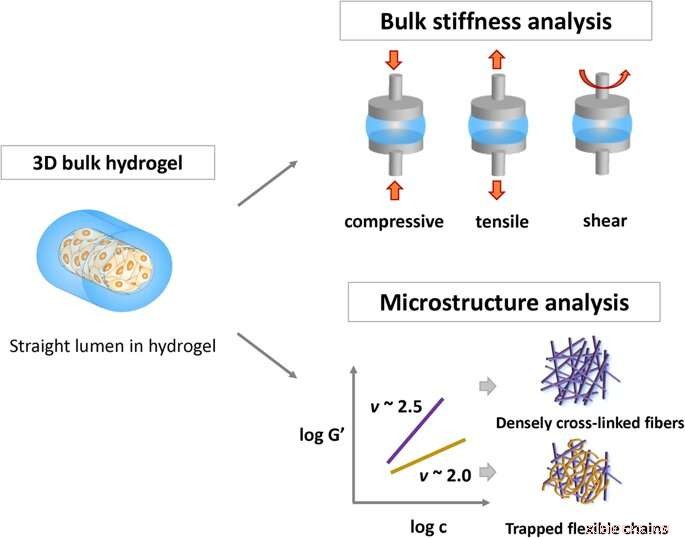
Skematisk repræsentation af metoder til karakterisering af hydrogels fysiske egenskaber:hydrogels bulkstivhed og kædefleksibilitet i viskoelastiske netværk gennem den semi-fleksible model. Kredit: Videnskabelige rapporter , doi:https://doi.org/10.1038/s41598-019-38951-7
Hydrogeler bruges almindeligvis som biomaterialer til anvendelser i biomedicin på grund af deres biokompatibilitet. Imidlertid, forholdet mellem biologiske celler og hydrogeloverfladen er stadig uklart, og de eksisterende parametre til at forklare interaktionerne er ikke sofistikerede nok. I en nylig undersøgelse, Jooyoung Lee, Boa Song og kolleger ved Center for Biomaterials og Institut for Polymer Engineering i Republikken Korea undersøgte virkningen af polymerkædefleksibilitet på celleadhæsion, med en række hydrogelkonstruktioner sammensat af de naturlige polymerer kollagen og fibrin.
De introducerede en ny metode til semi-fleksibel, modelbaseret analyse for at bekræfte, at kædefleksibilitet medierede hydrogel-mikrostrukturen som en kritisk faktor, der tillod celleadhæsion ved celle-materiale-grænsefladen. Analysen foreslået i undersøgelsen er i stand til mere præcist at forudsige biokompatibilitet (cytokompatibilitet) af hydrogeler. Resultater af arbejdet nu offentliggjort i videnskabelige rapporter, give et vigtigt kriterium for polymerdesign og -udvikling ved at forbedre biokompatibilitet og biofunktionalisering ved celle-materiale-grænsefladen til biomedicinske applikationer in vivo.
Hydrogeler er lavet af polymernetværk, der er opsvulmet med vand og har anvendelser inden for lægemiddellevering og vævsteknologi. Cellematerialeadhæsion er afgørende for in vivo biokompatibilitet, og de fleste undersøgelser har testet celleadfærd ved at analysere bulkstivheden af materialesammensætningen. Alligevel, kommunikation mellem celler ved hydrogeloverfladen mangler at blive præcist forstået. FDA godkendte naturlige polymerer kollagen og fibrin, giver fremragende biokompatibilitet til biomedicinske applikationer. Også kendt som semi-fleksible polymerer, de overholder ikke modeller af fleksible kædeløsninger eller stive stang-netværk. Den semi-fleksible model tillader forudsigelse af kædefleksibilitet af polymernetværk ved eksperimentelt at skalere det elastiske plateaumodul.
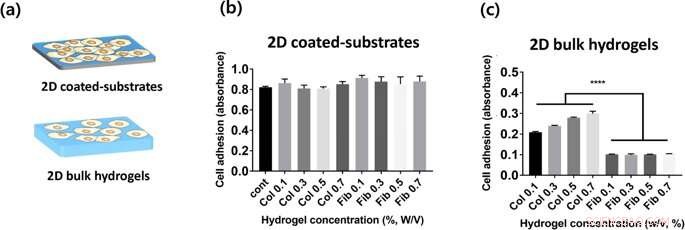
(a) Repræsentation af 2 typer hydrogelkonstruktioner evalueret i denne undersøgelse. (b, c) Adhæsion af HUVEC-celler på kollagen- og fibringeler på topoverflader af 2D-hydrogel-coatede plader (b) og bulk-hydrogel (c), som måles ved CCK-8 assay 2 timer efter podning. Kredit: Videnskabelige rapporter , doi:https://doi.org/10.1038/s41598-019-38951-7
I den nye undersøgelse, Lee og Song et al. foreslået en ny, semi-fleksibel modelbaseret analyse for at forstå celleadhæsion til hydrogeler ved hjælp af de velkarakteriserede kollagen- og fibrinpolymerer. De brugte tre forskellige kollagen- og fibrinbestanddele, at undersøge de faktorer, der bestemte celleadhæsion:
- Todimensionelle (2-D) belagte underlag.
- 2-D bulk hydrogeler, og
- 3-D bulk hydrogeler
Forskerne varierede hydrogelkoncentrationen i materialets bestanddele fra 1 mg/mL til 7 mg/mL og kvantificerede bulkstivheden og ruheden af de nydannede biomaterialer. For at definere parametrene for cellevedhæftning, de observerede kædemorfologien af de nye materialer. Resultaterne bekræftede, at mikroarkitekturen af hydrogeler påvirkede kædefleksibilitet som en afgørende faktor, der påvirker celleadhæsion.
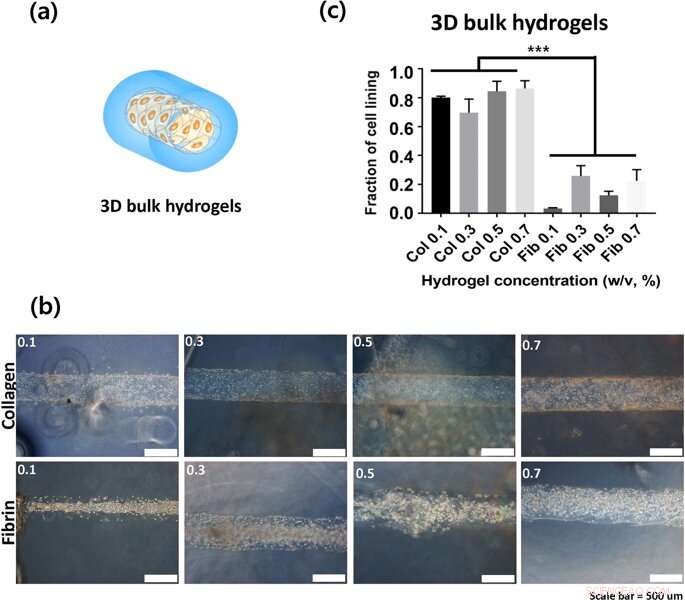
(a) Repræsentation af 3D bulk hydrogel konstruktioner (b) Den indre overflade af hule kanaler, hvor billederne blev fanget 24 timer efter podning. (c) Fraktionen af cellebeklædning som kvantificering af celleadhæsion. Kredit: Videnskabelige rapporter , doi:https://doi.org/10.1038/s41598-019-38951-7
I forsøgsopstillingen, forskerne forberedte en række kollagen- og fibrinkonstruktioner, at teste celleadhæsion uden tyngdekraftseffekter. De kontrollerede hydrogelstivhed ved hjælp af inkrementelle koncentrationer af hver komponent og kvantificerede spændings-belastningsforholdet baseret på aksial (træk eller tryk) og rotations- (forskydnings)spænding. For at måle de rheologiske egenskaber af hydrogelerne, forskerne brugte et stresskontrolleret rheometer. De målte derefter kompressionsmodulet til trækprøvning med en universel testmaskine. For at undersøge overfladetopografi, forskerne brugte et atomkraftmikroskop, efterfulgt af mikroindentation for at måle Youngs modul (E) af hydrogelerne, hvor de beregnede gennemsnit (E) ved hjælp af JPK databehandlingssoftware. Lee og Song et al. mener, at undersøgelsen var den første til at undersøge celleadhæsion på hydrogeler ved hjælp af hældningen af elasticitet af model semi-fleksible polymerer.
Til cellekultur i laboratoriet, Lee og Song et al. brugte humane navlevene-endotelceller (HUVEC'er) som den foretrukne cellelinje. De målte hastigheden af celleadhæsion på forskellige koncentrationer af kollagen og fibrinhydrogeler i 2-D, og kvantificeret celleadhæsion under anvendelse af celletællingskittet 8 (CCK-8). Forskerne observerede ikke en statistisk signifikant forskel mellem celleadhæsion på 2-D kollagen og fibrincoatede substrater; muligvis fordi celler fornemmede de mekaniske egenskaber af cellekulturplader, i stedet for hydrogelernes materialeegenskaber. I 2-D bulk hydrogel overflader, celleadhæsion til kollagen (2-D bulk geler) var meget højere end på 2-D fibrin bulk geler. Desuden, da hydrogelkoncentrationen varierede, forskerne observerede, at cellevedhæftningen systematisk steg med den stigende koncentration af kollagen. Sammenlignet med, celleadhæsion på fibringler var uafhængig af koncentrationen af den inkorporerede hydrogel.
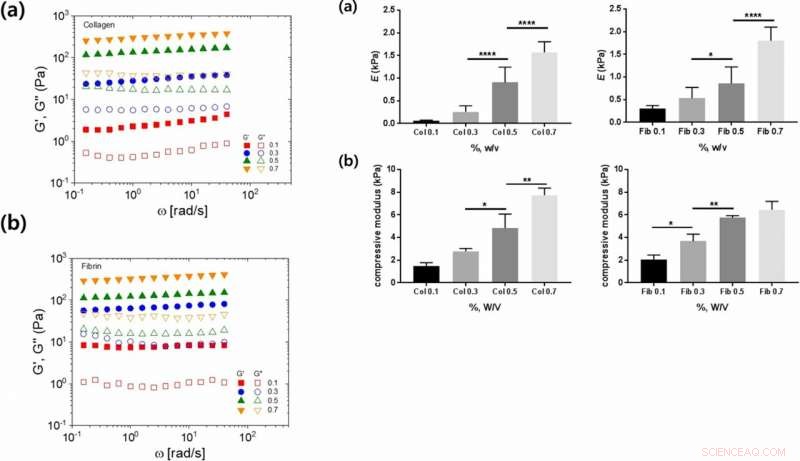
Til venstre:Lineære viskoelastiske egenskaber af kollagen- og fibrinhydrogeler som funktion af forskellige hydrogelkoncentrationer:(a, b) lagringsvinkelfrekvensafhængighed (G′, udfyldte symboler) og tab (G″, åbne symboler) moduler for (a) kollagen og (b) fibrinhydrogeler. Til højre:Mekaniske egenskaber af kollagen- og fibrinhydrogeler ved forskellige koncentrationer:(a) Youngs og (b) kompressionsmodul som funktion af kollagen- eller fibringelkoncentration. Kredit: Videnskabelige rapporter , doi:https://doi.org/10.1038/s41598-019-38951-7
Lee og Song et al. brugte derefter 3-D lumenstrukturer af hydrogeler for at tydeliggøre celleadhæsionshastigheden på kollagen- og fibringeler. De observerede, at cellerne var bedre knyttet til kollagen sammenlignet med fibringler. Celleadhæsionsfænotyper var også meget tydeligere på 3-D-konstruktionerne sammenlignet med vedhæftninger på 2-D. Typisk, celler hæfter til materialeoverflader eller den ekstracellulære matrix (ECM) via forankringspunkter kendt som fokale adhæsioner. Celler på stivere substrater indeholder generelt velorganiserede cytoskeletter til stabile fokale adhæsioner. For at forstå, om bulkhydrogeler kunne bidrage til celleadhæsion, forskerne plottede bulkstivheden af hydrogelerne og sammenlignede kollagen og fibrin i forskellige koncentrationer. Lee og Song et al. viste derved eksperimentelt, at bulkstivhed ikke var en kritisk faktor for at påvirke celleadhæsion på hydrogelerne.
Forskerne bestemte Youngs modul og kompressionsmodul som yderligere mekaniske egenskaber af de materialer, der påvirkede celleadhæsion. De viste, hvordan stivheden steg med stigende koncentration, og foreslog kædefleksibilitet som en passende parameter. På trods af den øgede stivhed med stigende koncentration af kollagen og fibrin, forskerne kunne ikke forklare de varierende celleadhæsionshastigheder, der blev observeret mellem de to polymerer.
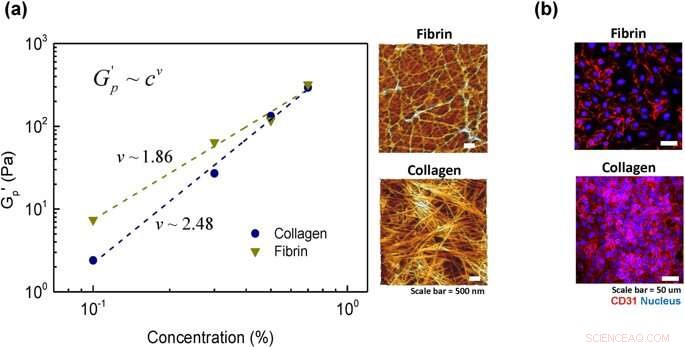
Analyse af hydrogelens kædefleksibilitet:(a) kraftlovsskalering af plateaumodul med en koncentration af hydrogel for kollagen og fibrin. Stiplede linjer er resultaterne af tilpasninger til magtlovens ligning G'p=cv og mikrostruktur af to repræsentative prøver med 0,5 % koncentration hver i kollagen og fibrin. (b) celleoverflademarkør, CD31, efter celler podet i 2 timer for to repræsentative prøver af kollagen og fibrin (0,5 % koncentration). Kredit: Videnskabelige rapporter , doi:https://doi.org/10.1038/s41598-019-38951-7
For det, Lee og Song et al. undersøgte arkitekturen af fibermolekyler og deres netværk i mikroskopisk skala ved hjælp af atomkraftmikroskopi. Kollagengeler udviste en fibrøs struktur som rapporteret før, med veldefinerede stangformede, semi-fleksible filamenter. Sammenlignet med, i fibringelstrukturen, forskerne observerede kun nogle få semi-fleksible filamenter, hvor det associerede protein var viklet ind som dynamisk fangede fleksible kæder. For at bekræfte graden af celle ved hydrogelvedhæftning, forskerne farvede cellerne med celleoverflademarkøren CD31 (glykoprotein udtrykt på endotelceller) og bekræftede endotelets stabile arkitektur på materialet.
Forskerne observerede, at den samlede cellebinding til kollagenhydrogel var større end på fibrinhydrogel. Resultaterne skyldtes den højere stivhed af kollagen i mikroskopisk skala, sammenlignet med fibrins relativt fleksible kædearkitektur. Forskerne viste således den mikroskopiske stivhed af hydrogeler som en dominerende faktor, der bestemte graden af cellebinding på en biomaterialeoverflade.
På denne måde Lee og Song et al. foreslået analytiske metoder i undersøgelsen til at beskrive samspillet mellem celleadhæsion og materialeoverflader. Resultaterne vil give væsentlige retningslinjer under biomaterialedesign i fremtiden, samtidig med at optimerede materialeegenskaber af holdbarhed og mekanisk styrke til hydrogelapplikationer in vivo integreres. Forskerne demonstrerede en semi-fleksibel, modelbaseret forklaring af celleadhæsion til biomaterialer ved at studere vævsstivhed for at kontrollere celleadhæsion, spredning og differentiering på de materielle konstruktioner. Forfatterne foreslår, at denne enkle metode kan forklare egenskaberne af celleadhæsion på polymere biomaterialer for præcise forudsigelser af biokompatibilitet. Resultaterne vil give et praktisk værktøj til at designe og konstruere 3-D kunstigt væv med højere biomekanisk præcision og biokompatibilitet til en række applikationer, såsom bioengineering af blodkar og lægemiddelleveringsmekanismer in vivo.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Video:Hvorfor limejuice brænder din hud i solenKredit:The American Chemical Society Vidste du, at det at lave margaritas og derefter tage til stranden kan give dig en smertefuld, hævelse brænde? I denne episode af Reaktioner, vi chatter med k
Video:Hvorfor limejuice brænder din hud i solenKredit:The American Chemical Society Vidste du, at det at lave margaritas og derefter tage til stranden kan give dig en smertefuld, hævelse brænde? I denne episode af Reaktioner, vi chatter med k -
 Forskere skaber kunstige organeller for at kontrollere cellulær adfærdIntrinsisk forstyrrede proteiner (fluorescerende grønt) klumper sig sammen i celler for at danne kunstige organeller. Kredit:Duke University Biomedicinske ingeniører ved Duke University har demons
Forskere skaber kunstige organeller for at kontrollere cellulær adfærdIntrinsisk forstyrrede proteiner (fluorescerende grønt) klumper sig sammen i celler for at danne kunstige organeller. Kredit:Duke University Biomedicinske ingeniører ved Duke University har demons -
 Selvmontering, biomimetiske kompositter besidder usædvanlige elektriske egenskaberBiomimetiske kompositter fremstilles ved topologiske interaktioner, udvidelse af grænserne for de fysiske egenskaber, såsom elektrisk ledningsevne. Kredit:Mert Vural, Penn State Sommetider, bryde
Selvmontering, biomimetiske kompositter besidder usædvanlige elektriske egenskaberBiomimetiske kompositter fremstilles ved topologiske interaktioner, udvidelse af grænserne for de fysiske egenskaber, såsom elektrisk ledningsevne. Kredit:Mert Vural, Penn State Sommetider, bryde -
 At vende et materiale på hovedet kan nogle gange gøre det blødereKunstnerisk fremstilling af det nye materiale. Kredit:ICN2 Gennem den kombinerede effekt af flexoelektricitet og piezoelektricitet, forskere ved ICN2 ledet af ICREA Gustau Catalán i samarbejde med
At vende et materiale på hovedet kan nogle gange gøre det blødereKunstnerisk fremstilling af det nye materiale. Kredit:ICN2 Gennem den kombinerede effekt af flexoelektricitet og piezoelektricitet, forskere ved ICN2 ledet af ICREA Gustau Catalán i samarbejde med
- Nyt nanomateriale introduceret i elektriske maskiner
- Byer og lande har til formål at reducere plastaffald inden for et årti
- Hubble fejrer sin 29-års fødselsdag med uovertruffen udsigt over den sydlige krabbetåge
- Forskning inspicerer emissionen fra millisekund pulsar PSR J0218+4232
- Hvad er de tre dele af en komet?
- Planetarisk videnskabspraktikant leder undersøgelse af Mars skorpe


