Forskere skaber kunstige organeller for at kontrollere cellulær adfærd
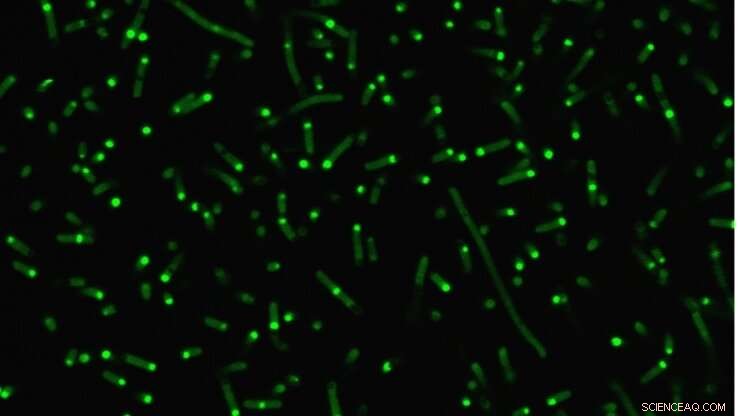
Intrinsisk forstyrrede proteiner (fluorescerende grønt) klumper sig sammen i celler for at danne kunstige organeller. Kredit:Duke University
Biomedicinske ingeniører ved Duke University har demonstreret en metode til at kontrollere faseadskillelsen af en ny klasse af proteiner for at skabe kunstige membranløse organeller i menneskelige celler. Fremskridtet, svarende til at kontrollere, hvordan eddike danner dråber i olie, skaber muligheder for at konstruere syntetiske strukturer til at modulere eksisterende cellefunktioner eller skabe helt ny adfærd i celler.
Resultaterne vises online den 3. august i tidsskriftet Naturkemi .
Proteiner fungerer ved at folde sig til specifikke 3D-former, der interagerer med forskellige biomolekylære strukturer. Forskere troede tidligere, at proteiner havde brug for disse faste former for at fungere. Men i de sidste to årtier, en stor ny klasse af iboende forstyrrede proteiner (IDP'er) er blevet opdaget, som har store områder, der er "floppy" - dvs. de foldes ikke til en defineret 3D-form. Det er nu forstået, at disse regioner spiller en vigtig, tidligere ukendt rolle i at kontrollere forskellige cellulære funktioner.
IDP'er er også nyttige til biomedicinske anvendelser, fordi de kan gennemgå faseovergange - skiftende fra en væske til en gel, for eksempel, eller fra en opløselig til en uopløselig tilstand, og tilbage igen - som reaktion på miljømæssige triggere, som ændringer i temperatur. Disse egenskaber dikterer også deres faseadfærd i cellulære miljøer og styres ved at justere karakteristika for IDP'erne, såsom deres molekylvægt eller sekvensen, hvori aminosyrerne er bundet sammen.
"Selvom der er mange naturlige IDP'er, der viser faseadfærd i celler, de kommer i mange forskellige smagsvarianter, og det har været svært at gennemskue de regler, der styrer denne adfærd, " sagde Ashutosh Chilkoti, Alan L. Kaganov Distinguished Professor of Biomedical Engineering ved Duke. "Dette papir giver meget enkle tekniske principper til at programmere denne adfærd i en celle."
"Andre i feltet har taget en top-down tilgang, hvor de vil foretage en ændring til en naturlig IDP og se, hvordan dens adfærd ændrer sig i en celle, " sagde Michael Dzuricky, en forsker, der arbejder i Chilkoti-laboratoriet og førsteforfatter af undersøgelsen. "Vi tager den modsatte tilgang og bygger vores egne kunstige IDP'er ud fra simple termodynamiske principper. Dette gør os og andre i stand til præcist at tune en enkelt egenskab - formen af IDP'ernes fasediagram - for bedre at forstå, hvordan denne parameter påvirker biologisk adfærd."
I det nye blad, forskerne begynder med at se på naturen efter eksempler på IDP'er, der samles for at danne "biomolekylære kondensater" i celler. Disse svagt holdt sammen strukturer tillader celler at skabe rum uden også at bygge en membran til at indkapsle den. Ved at bruge en sådan IDP fra den almindelige frugtflue som grundlag, forskerne trækker fra deres omfattende historie med at arbejde med IDP'er for at konstruere en molekylært enklere kunstig version, der bevarer den samme adfærd.
Denne enklere version gjorde det muligt for forskerne at foretage præcise ændringer af molekylvægten af IDP'erne og aminosyrerne i IDP'erne. Forskerne viser, at afhængigt af hvordan disse to variabler justeres, IDP'erne samles for at danne disse rum ved forskellige temperaturer i et reagensglas. Og ved konsekvent at prøve forskellige tweaks og temperaturer, forskerne fik en solid forståelse af, hvilke designparametre der er vigtigst for at kontrollere IDP's adfærd.
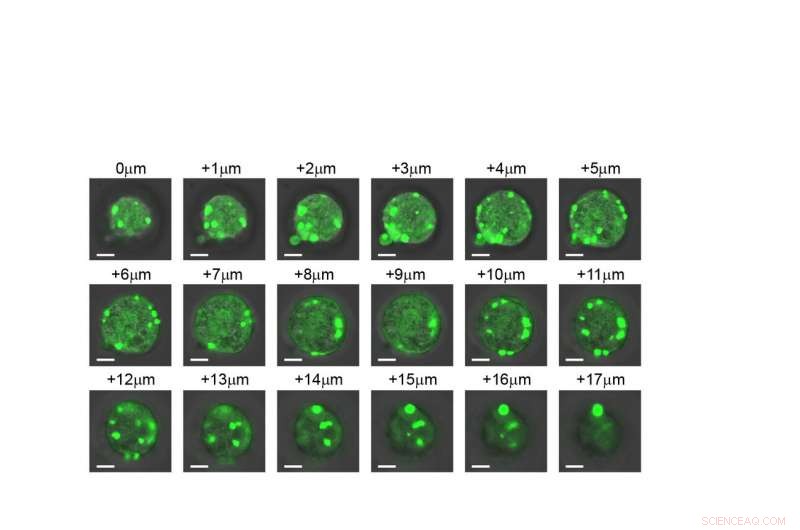
En skive-for-skive afbildning af en celle, der viser, at de kunstige organeller dannes gennem hele strukturen. Kredit:Duke University
Et reagensglas, imidlertid, er ikke det samme som en levende celle, så forskerne gik derefter et skridt videre for at demonstrere, hvordan deres konstruerede IDP'er opfører sig i E. coli. Som forudsagt, deres kunstige IDP'er grupperet sammen for at danne en lille dråbe i cellens cytoplasma. Og fordi IDP's adfærd nu var så godt forstået, forskerne viste, at de forudsigeligt kunne kontrollere, hvordan de smeltede sammen ved at bruge deres reagensglasprincipper som en guide.
"Vi var i stand til at ændre temperaturer i celler for at udvikle en komplet beskrivelse af deres faseadfærd, som afspejlede vores reagensglas forudsigelser, " sagde Dzuricky. "På dette tidspunkt, vi var i stand til at designe forskellige kunstige IDP-systemer, hvor de dråber, der dannes, har forskellige materialeegenskaber."
Sagt på en anden måde, fordi forskerne forstod, hvordan man manipulerede størrelsen og sammensætningen af IDP'erne for at reagere på temperatur, de kunne programmere IDP'erne til at danne dråber eller rum med varierende tæthed i celler. For at vise, hvordan denne evne kan være nyttig for biomedicinske ingeniører, forskerne brugte derefter deres nyfundne viden, som naturen ofte gør, at skabe en organel, der udfører en bestemt funktion i en celle.
Forskerne viste, at de kunne bruge IDP'erne til at indkapsle et enzym for at kontrollere dets aktivitetsniveau. Ved at variere molekylvægten af IDP'erne, IDP'erne holder på enzymet enten øget eller reduceret, hvilket igen påvirkede, hvor meget det kunne interagere med resten af cellen.
For at demonstrere denne evne, forskerne valgte et enzym, som E. coli bruger til at omdanne laktose til brugbare sukkerarter. Imidlertid, I dette tilfælde, forskerne sporede dette enzyms aktivitet med en fluorescerende reporter i realtid for at bestemme, hvordan den konstruerede IDP-organel påvirkede enzymaktiviteten.
I fremtiden, forskerne mener, at de kunne bruge deres nye IDP-organeller til at kontrollere aktivitetsniveauerne for biomolekyler, der er vigtige for sygdomstilstande. Eller for at lære, hvordan naturlige IDP'er udfylder lignende cellulære roller og forstår, hvordan og hvorfor de nogle gange ikke fungerer.
"Dette er første gang nogen har været i stand til præcist at definere, hvordan proteinsekvensen kontrollerer faseadskillelsesadfærd inde i celler, " sagde Dzuricky. "Vi brugte et kunstigt system, men vi tror, at de samme regler gælder for naturlige internt fordrevne og er spændte på at begynde at teste denne teori."
"Vi kan også nu begynde at programmere denne type faseadfærd med et hvilket som helst protein i en celle ved at fusionere dem til disse kunstige IDP'er, " sagde Chilkoti. "Vi håber, at disse kunstige IDP'er vil give et nyt værktøj til syntetisk biologi til at kontrollere celleadfærd."
 Varme artikler
Varme artikler
-
 Naturinspirerede antibakterielle metallerKredit:pattyphotoart, Shutterstock Fra luftfart til medicin, forskellige sektorer bruger i stigende grad materialer, der efterligner lotusplanten, hvis blade har selvrensende egenskaber. Takket væ
Naturinspirerede antibakterielle metallerKredit:pattyphotoart, Shutterstock Fra luftfart til medicin, forskellige sektorer bruger i stigende grad materialer, der efterligner lotusplanten, hvis blade har selvrensende egenskaber. Takket væ -
 Nye fotoresponsive hydrogeler udviklet med øje for biomedicinske applikationerFotomønsteret falmer fra hydrogel med tiden og udsættelse for luft. (Billede udlånt af Barnes laboratorium) 3-D printet, transplanterbare organer kan lyde som science fiction, men, takket være fre
Nye fotoresponsive hydrogeler udviklet med øje for biomedicinske applikationerFotomønsteret falmer fra hydrogel med tiden og udsættelse for luft. (Billede udlånt af Barnes laboratorium) 3-D printet, transplanterbare organer kan lyde som science fiction, men, takket være fre -
 Indkapslede proteinoscillationer forårsager dynamiske membrandeformationer i cellerComputergenereret afbildning af proteinholdige kæmpe vesikler. Kredit:Thomas Litschel/MPI fra Biochemistry Hvilke kriterier skal en syntetisk skabt celle opfylde for at blive betragtet som levende
Indkapslede proteinoscillationer forårsager dynamiske membrandeformationer i cellerComputergenereret afbildning af proteinholdige kæmpe vesikler. Kredit:Thomas Litschel/MPI fra Biochemistry Hvilke kriterier skal en syntetisk skabt celle opfylde for at blive betragtet som levende -
 Forskellen mellem deponering og sublimeringI naturen kan stoffer eksistere som faste stoffer, væsker, gasser eller plasma. Overganger mellem disse tilstande kaldes faseændringer og foregår under visse tryk- og temperaturforhold. Sublimering og
Forskellen mellem deponering og sublimeringI naturen kan stoffer eksistere som faste stoffer, væsker, gasser eller plasma. Overganger mellem disse tilstande kaldes faseændringer og foregår under visse tryk- og temperaturforhold. Sublimering og
- Sådan fungerer spontan menneskelig forbrænding
- En model til optimering af brugen af lokaltog
- Fysikere konstruerer et optisk spejl, der kun består af nogle få hundrede atomer
- Multiscale afgrødemodelleringsindsats påkrævet for at vurdere tilpasning af klimaændringer
- Eksklusiv analyse:Højskolestuderendes stemmeafgivelse blev fordoblet i 2018
- Hvad betyder opløselig i videnskaben?


