Er fluorioniseringsenergi højt medium eller lavt?
Her er hvorfor:
* lille atomstørrelse: Fluor er det mindste atom i halogengruppen. Dette betyder, at dens elektroner holdes tæt på kernen og oplever en stærk attraktion.
* Høj nuklearafgift: Fluor har 9 protoner i sin kerne, hvilket resulterer i en stærk positiv ladning, der trækker elektroner tæt.
* Effektiv nuklearafgift: Fluor har en høj effektiv nuklear ladning, hvilket betyder, at de yderste elektroner oplever en stærk attraktion fra kernen på trods af tilstedeværelsen af indre elektroner.
Disse faktorer bidrager alle til en meget høj ioniseringsenergi for fluor. Det kræver en betydelig mængde energi at fjerne et elektron fra et fluoratom.
 Varme artikler
Varme artikler
-
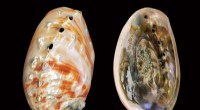 Teknik afslører dybere indsigt i sammensætningen af perlemor, et naturmaterialeDet ydre lag af en abaloneskal, set her, poleres indtil det perlemorlag er blottet. Forskere ved MIT har korreleret mikro-indentation og piezo-Raman-resultater for at evaluere og kvantificere mængden
Teknik afslører dybere indsigt i sammensætningen af perlemor, et naturmaterialeDet ydre lag af en abaloneskal, set her, poleres indtil det perlemorlag er blottet. Forskere ved MIT har korreleret mikro-indentation og piezo-Raman-resultater for at evaluere og kvantificere mængden -
 Blomsterlignende nanostrukturer i natriumbatterierNatrium-ion-batterier (SIB) er varme kandidater til en billig og bæredygtig batteriteknologi, men et tilbagevendende problem er anode-ustabilitet. Et kinesisk hold af videnskabsmænd rapporterer nu om
Blomsterlignende nanostrukturer i natriumbatterierNatrium-ion-batterier (SIB) er varme kandidater til en billig og bæredygtig batteriteknologi, men et tilbagevendende problem er anode-ustabilitet. Et kinesisk hold af videnskabsmænd rapporterer nu om -
 Undersøgelse identificerer kemiske blandinger som mulige alternative kølemidlerEn opvarmning, ventilations- og klimaanlæg (HVAC) får rengøring på en luftvåbenbase i Nigeria. Kredit:Jimmie Pike/US Air Force Mere end et dusin kemiske blandinger kunne tjene som alternative køle
Undersøgelse identificerer kemiske blandinger som mulige alternative kølemidlerEn opvarmning, ventilations- og klimaanlæg (HVAC) får rengøring på en luftvåbenbase i Nigeria. Kredit:Jimmie Pike/US Air Force Mere end et dusin kemiske blandinger kunne tjene som alternative køle -
 Fremstilling af stof af træKredit:Janko Ferlic Som et materiale har træ mange anvendelsesmuligheder, men vidste du, at det kan bruges til at lave fibre til tøj og andre tekstiler? Måske overraskende, det er råmaterialet i n
Fremstilling af stof af træKredit:Janko Ferlic Som et materiale har træ mange anvendelsesmuligheder, men vidste du, at det kan bruges til at lave fibre til tøj og andre tekstiler? Måske overraskende, det er råmaterialet i n
- Telemedicin via satellit forbedrer plejen ved astronautlandinger
- Maskinlæring kan muliggøre bioteknik af det mest udbredte enzym på planeten
- Youtube delvist ansvarlig for brud på ophavsretten:Østrigsk domstol
- Hvad er kropsplaceringen af bugspytkirtlen?
- Hvilken af scenevandscyklussen er forårsaget, når den absorberer varmeenergi fra solen?
- Elastisk lægemiddelleveringsteknologi frigiver lægemidler, når de strækkes


