Hvorfor er fluor mindre end ilt?
Her er grunden til, at fluor er større end ilt:
* Effektiv nuklearafgift: Fluor har endnu en proton end ilt, hvilket fører til en stærkere attraktion mellem kernen og elektronerne. Dette stærkere træk kan muligvis føre til, at du tror, at fluor ville være *mindre *.
* Elektronelektronafvisning: Imidlertid har både fluor og ilt en fuld ydre skal af elektroner (2S²2p⁵). Dette betyder, at der i fluor er mere elektronelektron-frastødning på grund af den ekstra elektron. Denne frastødning skubber elektronerne længere fra hinanden og øger atomradius.
I det væsentlige, mens fluor har et stærkere træk fra kernen, opvejer den øgede elektronelektronafvisning denne effekt, hvilket gør fluor større end ilt.
Fortæl mig, hvis du gerne vil udforske andre periodiske tendenser!
 Varme artikler
Varme artikler
-
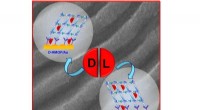 Forskere udvikler superfølsomme sensorer til spejlmolekyler i medicinKredit:Tomsk Polytechnic University (TPU) Forskere fra Tomsk Polytechnic University har sammen med kolleger fra Tjekkiet udviklet superfølsomme sensorer til påvisning af enantiomerer, kendt som sp
Forskere udvikler superfølsomme sensorer til spejlmolekyler i medicinKredit:Tomsk Polytechnic University (TPU) Forskere fra Tomsk Polytechnic University har sammen med kolleger fra Tjekkiet udviklet superfølsomme sensorer til påvisning af enantiomerer, kendt som sp -
 Brug af gennemsigtigt blæk til at udskrive farvebillederKredit:Pixabay/CC0 Public Domain Et team af forskere tilknyttet en lang række institutioner i Kina har udviklet en ny måde at printe farvebilleder på ved hjælp af standard inkjet-printere. I deres
Brug af gennemsigtigt blæk til at udskrive farvebillederKredit:Pixabay/CC0 Public Domain Et team af forskere tilknyttet en lang række institutioner i Kina har udviklet en ny måde at printe farvebilleder på ved hjælp af standard inkjet-printere. I deres -
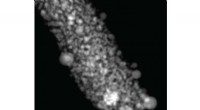 Ny elektrokatalysator udkonkurrerer platin i produktionen af alkalisk brintDen nye katalysator er et nanostruktureret kompositmateriale sammensat af carbon nanotråde med rutheniumatomer bundet til nitrogen og carbon for at danne aktive steder i carbonmatrixen. Elektronmikros
Ny elektrokatalysator udkonkurrerer platin i produktionen af alkalisk brintDen nye katalysator er et nanostruktureret kompositmateriale sammensat af carbon nanotråde med rutheniumatomer bundet til nitrogen og carbon for at danne aktive steder i carbonmatrixen. Elektronmikros -
 Forskere dechifrerer strukturen af lovende metalorganiske rammerForskere ved MIT og andre institutioner har fundet en måde at stabilisere væksten af krystaller af flere slags metalorganiske rammer, eller MOFer. Dette billede viser to scanning elektronmikroskopi
Forskere dechifrerer strukturen af lovende metalorganiske rammerForskere ved MIT og andre institutioner har fundet en måde at stabilisere væksten af krystaller af flere slags metalorganiske rammer, eller MOFer. Dette billede viser to scanning elektronmikroskopi
- Hvad er navnene på elementer, der bruges til at skabe lys i en stjerne?
- Undersøgelser får et øre af, hvordan pattedyr udviklede hørelsen
- Hvilke planteceller bærer mad?
- Hvorfor er knæspændingen for germanium 0,2v?
- Hvad er et Thorne-Zytkow-objekt, og hvordan adskiller det sig fra andre astronomiske fænomener?
- Google tøjler politisk annoncering


