Hvilken har den højeste elektronforstærkning entalpi mellem klor og fluor Hvorfor?
Forklaring:
* elektronforstærkning entalpi er ændringen i energi, der opstår, når der tilsættes et elektron til et neutralt atom i den gasformige tilstand for at danne en negativ ion.
* størrelse: Fluor er mindre i størrelse end klor. Som et resultat oplever den tilsatte elektron i fluor en stærkere attraktion fra kernen, hvilket fører til en større frigørelse af energi.
* Inter-elektroniske afvisninger: I fluor tilsættes det indkommende elektron til 2p-orbitalen, som allerede er halvfyldt. Dette resulterer i større inter-elektroniske afvisninger, hvilket gør det mindre gunstigt at tilføje en anden elektron. I klor går den tilsatte elektron ind i en 3p orbital, som er mindre overfyldt, hvilket fører til færre frastødelser.
* Effektiv nuklearafgift: Selvom fluor har en højere nuklear ladning, oplever elektronerne i 2p -orbitaler af fluor en stærkere afskærmningseffekt fra de indre elektroner sammenlignet med klor. Dette reducerer den effektive nukleare ladning, som den tilsatte elektron oplever i fluor.
På trods af at fluor er mere elektronegativ, har chlor en højere elektronforstærkning entalpi på grund af dens større størrelse, lavere inter-elektroniske frastødninger og en lidt højere effektiv nuklear ladning, der opleves af den tilføjede elektron.
Bemærk: Elektronforstærkningen af fluor er stadig meget eksotermisk, men den er mindre eksoterm end klor.
Sidste artikelHvad forårsager svovloxid?
Næste artikelHvorfor er fluor mindre end ilt?
 Varme artikler
Varme artikler
-
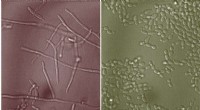 Molekyler fundet i slim kan modvirke svampeinfektionDen mere smitsomme form for gæren Candida albicans er en lang filament (til venstre). MIT-forskere har vist, at når gæren dyrkes i nærværelse af mucinglykaner, forbliver den i sin runde, harmløse form
Molekyler fundet i slim kan modvirke svampeinfektionDen mere smitsomme form for gæren Candida albicans er en lang filament (til venstre). MIT-forskere har vist, at når gæren dyrkes i nærværelse af mucinglykaner, forbliver den i sin runde, harmløse form -
 Efterligner træets ultrastruktur med 3D-print til grønne produkterEfterligner træets naturlige cellulære arkitektur. Den trykte version er i større skala for nem håndtering og visning, men forskerne er i stand til at udskrive i enhver skala. Kredit:Yen Strandqvist/C
Efterligner træets ultrastruktur med 3D-print til grønne produkterEfterligner træets naturlige cellulære arkitektur. Den trykte version er i større skala for nem håndtering og visning, men forskerne er i stand til at udskrive i enhver skala. Kredit:Yen Strandqvist/C -
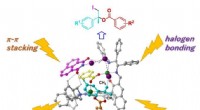 Asymmetrisk jodesterificering af simple alkener ved koncertkatalysatorDe integrerede grundlæggende kræfter ved metalionisk binding, hydrogenbinding, halogenbinding, og π-π stabling spiller en kvartet på di-Zn-katalysatorens enkeltreaktionskugle. Kredit:Takayoshi Arai
Asymmetrisk jodesterificering af simple alkener ved koncertkatalysatorDe integrerede grundlæggende kræfter ved metalionisk binding, hydrogenbinding, halogenbinding, og π-π stabling spiller en kvartet på di-Zn-katalysatorens enkeltreaktionskugle. Kredit:Takayoshi Arai -
 At bryde fatbergs op - ingeniører udvikler teknik til at nedbryde fedtstoffer, olie og fedtEn UBC-metode til at nedbryde fedtstoffer, olie og fedt kan bruges i kommunale FOG-styringsprogrammer. Kredit:Clare Kiernan/UBC Madolie og lignende affald kan tilstoppe rør, skade fisk og endda vo
At bryde fatbergs op - ingeniører udvikler teknik til at nedbryde fedtstoffer, olie og fedtEn UBC-metode til at nedbryde fedtstoffer, olie og fedt kan bruges i kommunale FOG-styringsprogrammer. Kredit:Clare Kiernan/UBC Madolie og lignende affald kan tilstoppe rør, skade fisk og endda vo
- Hvor på hovedsekvensen er stjerner cool og svage?
- Hvilken form af jorden beskrives bedst som?
- Når små guldflager fjernes fra en vandopløsning ved filtrering, er denne kemiske ændring?
- Rolls-Royce fabriksplan sætter atomreaktorer i miniskala
- Fyrværkeri den 4. juli forårsagede det næsthøjeste luftforureningsniveau fra ferien i det sydlig…
- Penn Med-studerende opretter appendx, en ny journal for krop og ånd i COVID-19-tiden


