Hvad er retningen af netto dipol for svovldioxid?
Her er hvorfor:
* molekylær geometri: SO2 har en bøjet molekylær geometri på grund af tilstedeværelsen af to ensomme par elektroner på svovlatomet.
* polære obligationer: Svovl-iltbindingerne er polære, fordi ilt er mere elektronegativt end svovl, hvilket skaber en delvis negativ ladning på iltatomerne og en delvis positiv ladning på svovlatomet.
* Vector tilføjelse: De to polære bindinger skaber individuelle dipolmomenter, der peger mod iltatomerne. Disse dipolmomenter annullerer ikke hinanden på grund af den bøjede geometri. I stedet tilføjer de vektorialt for at danne et netto dipol -øjeblik, der også peger mod iltatomerne.
Derfor er netto-dipolmomentet for SO2 ikke-nul og peger mod iltatomerne, hvilket gør det til et polært molekyle .
 Varme artikler
Varme artikler
-
 Modellen lærer, hvordan individuelle aminosyrer bestemmer proteinfunktionenEn ny model udviklet af MIT-forskere skaber rigere, lettere beregnelige repræsentationer af, hvordan individuelle aminosyrer bestemmer et proteins funktion, som kunne bruges til at designe og teste ny
Modellen lærer, hvordan individuelle aminosyrer bestemmer proteinfunktionenEn ny model udviklet af MIT-forskere skaber rigere, lettere beregnelige repræsentationer af, hvordan individuelle aminosyrer bestemmer et proteins funktion, som kunne bruges til at designe og teste ny -
 Video:Sådan virker dobbeltvirkende bagepulver to gangeKredit:The American Chemical Society Bagepulver bruges til at hæve bagværk som kager og småkager. Det sælges ofte under mærket dobbeltvirkende, men hvad betyder det? I denne video, Reaktioner for
Video:Sådan virker dobbeltvirkende bagepulver to gangeKredit:The American Chemical Society Bagepulver bruges til at hæve bagværk som kager og småkager. Det sælges ofte under mærket dobbeltvirkende, men hvad betyder det? I denne video, Reaktioner for -
 Kemikere designer hurtigere produktionsproces for essentielle sukkerarterKredit:CC0 Public Domain Celler fra alle levende organismer er dækket af et tæt lag af meget komplekse kulhydrater. Disse kulhydrater, som også er kendt som glykaner, er væsentlige mediatorer af e
Kemikere designer hurtigere produktionsproces for essentielle sukkerarterKredit:CC0 Public Domain Celler fra alle levende organismer er dækket af et tæt lag af meget komplekse kulhydrater. Disse kulhydrater, som også er kendt som glykaner, er væsentlige mediatorer af e -
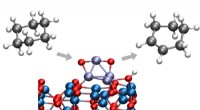 Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved
Forskere er banebrydende for den nye kemiske konverteringsproces ved lav temperaturArgonne -kemikere har identificeret en måde at konvertere cyclohexan til cyclohexen eller cyclohexadien, begge vigtige kemikalier i en lang række industrielle processer. Den nye proces finder sted ved
- Hvorfor ideen om, at engelsk har en fælles angelsaksisk oprindelse, er en myte
- Hvad er de to hoveddele af en nefron?
- Hvordan affald, spredning og en opvarmning af verden påvirker Michigans myggesæsoner
- Geologer afslører, at anoksi forårsagede tab af biodiversitet i gamle hav
- Hvad er strukturer i Uveal -kanalen?
- Hvornår forventes solenergien at være let tilgængelig offentligheden?


