Hvilke elementer og forbindelser kan flytte fra fase til en anden?
elementer:
* Gasser: Alle elementer findes som gasser ved tilstrækkeligt høje temperaturer. For eksempel er ilt (O2), nitrogen (N2) og helium (HE) alle gasser ved stuetemperatur.
* væsker: Nogle elementer, som Brom (BR2) og Mercury (HG), er væsker ved stuetemperatur. Andre, som vand (H2O) og ethanol (C2H5OH), kan flydende ved at øge trykket.
* faste stoffer: De fleste elementer er solide ved stuetemperatur. Eksempler inkluderer jern (Fe), guld (AU) og carbon (C). Nogle elementer, som fosfor (P), kan eksistere i flere faste former (allotropes) med forskellige egenskaber.
Forbindelser:
* Gasser: Mange forbindelser er gasser ved stuetemperatur, som kuldioxid (CO2), methan (CH4) og ammoniak (NH3).
* væsker: Vand (H2O), ethanol (C2H5OH) og acetone (CH3COCH3) er almindelige eksempler på flydende forbindelser.
* faste stoffer: De fleste forbindelser er faste ved stuetemperatur, inklusive bordsalt (NaCl), sukker (C12H22O11) og plast.
faseovergange:
Bevægelsen af et stof fra en fase til et andet kaldes en faseovergang. Almindelige faseovergange inkluderer:
* smeltning: Fast til væske (f.eks. Is, der smelter i vandet)
* Frysning: Væske til fast (f.eks. Vandfrysning i is)
* fordampning: Væske til gas (f.eks. Vandkogning i damp)
* kondens: Gas til væske (f.eks. Dampkondensering i vanddråber)
* sublimering: Fast til gas (f.eks. Tøris, der drejer direkte til kuldioxidgas)
* afsætning: Gas til fast (f.eks. Frost, der dannes på en kold overflade)
Faktorer, der påvirker faseovergange:
* Temperatur: Forøgelse af temperaturen favoriserer generelt overgange til højere energifaser (fast til væske, væske til gas).
* tryk: Stigende tryk favoriserer generelt overgange til tættere faser (gas til væske, væske til fast).
* Intermolekylære kræfter: Styrken af de attraktive kræfter mellem molekyler (f.eks. Hydrogenbinding, dipol-dipolinteraktioner) spiller en rolle i bestemmelsen af fasen ved en given temperatur og tryk.
Bemærk:
Ikke alle stoffer kan eksistere i alle tre faser under normale forhold. For eksempel nedbrydes nogle materialer, før de kan nå deres kogepunkt.
Sidste artikelHvordan opdager natriummetal?
Næste artikelHvor mange atomer af hver type er i 4HNO3?
 Varme artikler
Varme artikler
-
 Plantebaserede proteiner til kødelskereUdforskning af kødteksturer:mikrocomputertomografi (µCT) viser produktstrukturen. Kredit:Patrick Wittek, SÆT I kantiner og supermarkeder, plantebaserede erstatningsprodukter til kyllingescalopes o
Plantebaserede proteiner til kødelskereUdforskning af kødteksturer:mikrocomputertomografi (µCT) viser produktstrukturen. Kredit:Patrick Wittek, SÆT I kantiner og supermarkeder, plantebaserede erstatningsprodukter til kyllingescalopes o -
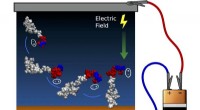 Implanterbart medicinsk udstyr forstærket af næste generations overflademodifikationKontrol af peptidorientering ved hjælp af elektrisk felt. Ladeseparation i den ene ende af peptidet skaber et dipolmoment (angivet med ellipser), der flugter med det elektriske felt og roterer hele mo
Implanterbart medicinsk udstyr forstærket af næste generations overflademodifikationKontrol af peptidorientering ved hjælp af elektrisk felt. Ladeseparation i den ene ende af peptidet skaber et dipolmoment (angivet med ellipser), der flugter med det elektriske felt og roterer hele mo -
 En ny polyethylen-B4C baseret beton til afskærmningKredit:ESS/SINE2020 Afskærmning spiller en vigtig rolle ved neutronkilder for både strålingssikkerhed og for at minimere baggrundsstøj i neutronforsøg. Afskærmning er regelmæssigt lavet af beton,
En ny polyethylen-B4C baseret beton til afskærmningKredit:ESS/SINE2020 Afskærmning spiller en vigtig rolle ved neutronkilder for både strålingssikkerhed og for at minimere baggrundsstøj i neutronforsøg. Afskærmning er regelmæssigt lavet af beton, -
 Frigør potentialet for metalnanopartikler som katalysatorer for hurtig og effektiv CO2-omdannelseNano-arkitektur:nikkelpartikler præcis 1/40, 000. på størrelse med et menneskehår er de bedste katalysatorer til omdannelse af CO2. Kredit:Utrecht University / Uorganisk kemi og katalyse O 2 og
Frigør potentialet for metalnanopartikler som katalysatorer for hurtig og effektiv CO2-omdannelseNano-arkitektur:nikkelpartikler præcis 1/40, 000. på størrelse med et menneskehår er de bedste katalysatorer til omdannelse af CO2. Kredit:Utrecht University / Uorganisk kemi og katalyse O 2 og
- Genomstruktur af dinosaurer opdaget ved sammenligning af fugle-skildpadder
- Hvor meget momentum har et objekt, der ikke bevæger sig?
- Hvordan er dine sanser vigtige for at identificere materielle egenskaber ved stof?
- Hvilken slags gasser er der i tåge?
- Hvilke typer celler er involveret i modtagelse og behandling af oplysninger?
- Rapport:Kvindelige økonomer underrepræsenteret på alle niveauer i den britiske akademiske verden


