Når ammoniumchlorid opløses i et bægerglas af vand, bliver det koldt at røre ved at røre ved dette fænomen?
* endotermiske reaktioner: Disse reaktioner absorberer varme fra deres omgivelser. Dette betyder, at energi kræves for at bryde bindingerne i reaktanterne, og mindre energi frigives, når der dannes nye obligationer i produkterne.
* opløste ammoniumchlorid: Når ammoniumchlorid opløses, sker følgende:
* Breaking Bonds: De ioniske bindinger, der holder ammonium (NH₄⁺) og chlorid (CL⁻) -ioner sammen i krystalgitteret, skal brydes. Dette kræver energi, der absorberes fra omgivelserne.
* Hydrering: Vandmolekyler omgiver ionerne og danner en hydratiseringsskal. Denne proces frigiver lidt energi, men den er mindre end den energi, der kræves for at bryde de ioniske bindinger.
* netto energiændring: Da mere energi absorberes for at bryde bindingerne end frigivet under hydrering, er den overordnede proces endotermisk. Dette betyder, at opløsningen absorberer varme fra omgivelserne, hvilket får bægeret til at føle sig koldt.
i enklere termer:
Tænk på processen som denne:Du prøver at bryde en tæt pakket gruppe mennesker (ammoniumchloridkrystallen). Det kræver indsats (energi) at adskille dem. Derefter omgiver du hver person med en gruppe venner (vandmolekyler). Dette frigiver lidt energi, men ikke nok til at kompensere for den oprindelige indsats. Da energi blev taget fra omgivelserne (bægerglas og din hånd), føler de sig koldere.
 Varme artikler
Varme artikler
-
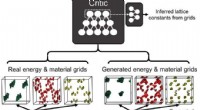 Omvendt design af porøse materialer ved hjælp af kunstige neurale netværkOverordnede skemaer af ZeoGAN. Energi (grøn) refererer i dette tilfælde til potentiel metanenergi, og materialegitter angiver silicium (rød) og oxygen (gule) atomer. Kredit:Science Advances, doi:10.11
Omvendt design af porøse materialer ved hjælp af kunstige neurale netværkOverordnede skemaer af ZeoGAN. Energi (grøn) refererer i dette tilfælde til potentiel metanenergi, og materialegitter angiver silicium (rød) og oxygen (gule) atomer. Kredit:Science Advances, doi:10.11 -
 Ser på molekyler fra to sider med femtosekund bløde røntgenstråler på bordpladenFlydende flatjet (solvatiseret urea) belyst af en bredbånds blød røntgenimpuls opnået ved højordens harmonisk generering. Indsætningerne viser steady-state absorptionen af urinstof ved C- og N K-kan
Ser på molekyler fra to sider med femtosekund bløde røntgenstråler på bordpladenFlydende flatjet (solvatiseret urea) belyst af en bredbånds blød røntgenimpuls opnået ved højordens harmonisk generering. Indsætningerne viser steady-state absorptionen af urinstof ved C- og N K-kan -
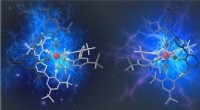 Mangan kunne gøre selvlysende materialer og omdannelsen af sollys mere bæredygtigFor første gang, Mangankomplekser viser de typer af luminescerende egenskaber og fotokatalytisk adfærd, der primært var forbundet med ædelmetalforbindelser indtil nu. Kredit:Jakob Bilger Basel Uni
Mangan kunne gøre selvlysende materialer og omdannelsen af sollys mere bæredygtigFor første gang, Mangankomplekser viser de typer af luminescerende egenskaber og fotokatalytisk adfærd, der primært var forbundet med ædelmetalforbindelser indtil nu. Kredit:Jakob Bilger Basel Uni -
 In-situ nanoskala indsigt i udviklingen af solide elektrolytinterfaseskallerSEI beskytter udviklingsprocesser og nedbrydningsmekanisme ved elektrode/elektrolytgrænsefladen. Kredit:Science China Press De grænseflade-nedbrydningsprodukter, der danner den såkaldte fast-elekt
In-situ nanoskala indsigt i udviklingen af solide elektrolytinterfaseskallerSEI beskytter udviklingsprocesser og nedbrydningsmekanisme ved elektrode/elektrolytgrænsefladen. Kredit:Science China Press De grænseflade-nedbrydningsprodukter, der danner den såkaldte fast-elekt
- Fysikere forklarer, hvordan store sfæriske vira dannes
- Hvilket grundlag er dannelses- og forbrændingsvarme defineret?
- Forskere belyser området for mikroskopi med nanopartikel-buckyswitch
- The Glass Armonica:A Harmonious Invention af Benjamin Franklin
- Forskere arbejder på at fremme forståelsen af hydrodynamiske ustabilitet i NIF, astrofysik
- Observere den ultrahurtige bevægelse af atomer og elektroner


