Hvilken type kraft holder ioner sammen i salte som NaCl?
Sådan fungerer det:
* Elektrostatisk attraktion: Natrium (NA) er et metal og mister let et elektron for at blive en positivt ladet ion (Na+). Chlor (CL) er en ikke-metal og får let et elektron til at blive en negativt ladet ion (Cl-). Disse modsatte anklager tiltrækker hinanden stærkt og danner en ionisk binding.
* Krystalgitter: Tiltrækningen mellem ioner i et salt strækker sig ud over bare de nærmeste naboer. Mange Na+ og Clions arrangerer sig selv i en regelmæssig, gentager tredimensionel struktur kaldet en krystalgitter. Dette arrangement maksimerer den elektrostatiske tiltrækning og stabiliserer strukturen.
Derfor er kraften, der holder Na+ og Cl-sammen i NaCI, den stærke elektrostatiske tiltrækning mellem modsat ladede ioner, som er et definerende egenskab ved ionisk binding.
 Varme artikler
Varme artikler
-
 Ny biosensor stimulerer sved, mens patienten er kølig og hvilerUC udviklede en ny biosensor, der stimulerer sved på et lille stykke hud. Kredit:Andrew Higley/UC Creative Services En ulempe ved medicinske sensorer, der tester menneskelig sved:Du skal svede.
Ny biosensor stimulerer sved, mens patienten er kølig og hvilerUC udviklede en ny biosensor, der stimulerer sved på et lille stykke hud. Kredit:Andrew Higley/UC Creative Services En ulempe ved medicinske sensorer, der tester menneskelig sved:Du skal svede. -
 Hærforsker bruger matematik til at afdække ny kemiI fremtiden, materialeforskere vil bruge avanceret software til at specificere de egenskaber, de ønsker, og et program vil levere et udvalg af optimerede kemiske forbindelser. Kredit:US Army illustrat
Hærforsker bruger matematik til at afdække ny kemiI fremtiden, materialeforskere vil bruge avanceret software til at specificere de egenskaber, de ønsker, og et program vil levere et udvalg af optimerede kemiske forbindelser. Kredit:US Army illustrat -
 Smarte magnetiske bløde materialer til udvikling af kunstige muskler og terapeutiske robotterInteraktionskræfter mellem magnetiske partikler omsættes til makroskopiske transformationer af de smarte polymerer. Kredit:4D-BIOMAP Udvikling af en ny generation af kunstige muskler og bløde nano
Smarte magnetiske bløde materialer til udvikling af kunstige muskler og terapeutiske robotterInteraktionskræfter mellem magnetiske partikler omsættes til makroskopiske transformationer af de smarte polymerer. Kredit:4D-BIOMAP Udvikling af en ny generation af kunstige muskler og bløde nano -
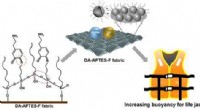 Flyder ind i sommeren med mere flydende, væsketætte redningsveste og badedragterKredit: ACS anvendte materialer og grænseflader (2021). DOI:10.1021/acsami.1c08844 Sommertiden er her, og det betyder ofte lang, dovne dage på stranden, vandski og svømning. Redningsveste og bade
Flyder ind i sommeren med mere flydende, væsketætte redningsveste og badedragterKredit: ACS anvendte materialer og grænseflader (2021). DOI:10.1021/acsami.1c08844 Sommertiden er her, og det betyder ofte lang, dovne dage på stranden, vandski og svømning. Redningsveste og bade
- Bedragerplanet afsløret af astronomer
- USA havde rekordbrande, historiske orkaner i oktober
- Billeddannelse af sekventielle potentielle fordelingsændringer i elektroder under opladning/afladni…
- Nanopartikelteknologi giver et sundt trans, mættet fedt alternativ
- Mere effektiv risikovurdering for nanomaterialer
- Forurenende stoffer fra naturbrande påvirker afgrøde- og vegetationsvæksten hundredvis af kilomet…


