Hvorfor har D blokelementet forskellige oxidationstilstand?
1. Elektronisk konfiguration:
* variabelt antal D-elektroner: D-blokelementer har et variabelt antal D-elektroner i deres yderste skal, der spænder fra 1 til 10. Disse elektroner kan deltage i kemisk binding, hvilket fører til flere oxidationstilstande.
* Relativt tætt energiniveau af D og S Orbitaler: Energiforskellen mellem D- og S -orbitaler er relativt lille, hvilket gør det muligt for elektroner fra begge at deltage i binding, hvilket resulterer i forskellige oxidationstilstande.
2. Overgangsmetaller:
* Dannelse af kationer: D-blokelementer mister let elektroner til dannelse af kationer. Antallet af mistede elektroner bestemmer oxidationstilstanden.
* stabilitet af ioner: Stabiliteten af forskellige oxidationstilstande påvirkes af faktorer som krystalfeltstabiliseringsenergi, ionisk radius og elementets elektronegativitet.
3. Faktorer, der påvirker oxidationstilstand:
* ligand: Arten af liganden, der er fastgjort til metalionen, kan påvirke oxidationstilstanden. Nogle ligander fremmer højere oxidationstilstande, mens andre favoriserer lavere.
* reaktionsbetingelser: Reaktionsbetingelserne, såsom temperatur, tryk og tilstedeværelsen af oxidation eller reduktionsmidler, kan også påvirke oxidationstilstanden.
Eksempler:
* mangan: Mangan kan udvise oxidationstilstande, der spænder fra +2 til +7.
* jern: Iron eksisterer ofte i +2 (jern) og +3 (ferrisk) oxidationstilstande, men kan også have andre oxidationstilstande.
* krom: Krom kan have oxidationstilstande, der spænder fra +2 til +6.
Undtagelser:
* skandium (SC) og zink (Zn): Disse elementer har kun en stabil oxidationstilstand (henholdsvis +3 og +2), fordi deres D-orbitaler enten er fuldstændigt fyldt eller tomme.
I resuméet bidrager det variable antal D-elektroner, de nære energiniveauer af D- og S-orbitaler og påvirkningen af ligander og reaktionsbetingelser til den brede række oxidationstilstande observeret i D-blokke elementer.
 Varme artikler
Varme artikler
-
 Forskere rapporterer om cellegennemtrængelige nanobodiesRingpeptider åbner cellemembrandøren og tillader antistoffer og andre terapeutiske midler at trænge ind i cellerne. Kredit:Christoph Hohmann, Nanosystems Initiative München (NIM) Forskere ved Tech
Forskere rapporterer om cellegennemtrængelige nanobodiesRingpeptider åbner cellemembrandøren og tillader antistoffer og andre terapeutiske midler at trænge ind i cellerne. Kredit:Christoph Hohmann, Nanosystems Initiative München (NIM) Forskere ved Tech -
 Edderkoppesilke:Et formbart protein giver forstærkningFiguren viser et edderkoppespind sammen med den undersøgte domænes molekylære struktur i bunden tilstand i overfladerepræsentation (struktur i rød/orange, øverste venstre hjørne). Aminosyrens methioni
Edderkoppesilke:Et formbart protein giver forstærkningFiguren viser et edderkoppespind sammen med den undersøgte domænes molekylære struktur i bunden tilstand i overfladerepræsentation (struktur i rød/orange, øverste venstre hjørne). Aminosyrens methioni -
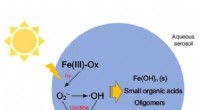 Virkninger af Fenton-lignende reaktioner af ferroloxalat på atmosfæriske oxidationsprocesser og st…Methacrolein reagerer med superoxidradikaler frembragt ved en Fenton-lignende reaktion. Dette påvirker atmosfærisk strålingsforcerende kraft på grund af dannelsen af uopløseligt jernhydroxid. Kredit
Virkninger af Fenton-lignende reaktioner af ferroloxalat på atmosfæriske oxidationsprocesser og st…Methacrolein reagerer med superoxidradikaler frembragt ved en Fenton-lignende reaktion. Dette påvirker atmosfærisk strålingsforcerende kraft på grund af dannelsen af uopløseligt jernhydroxid. Kredit -
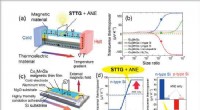 Demonstration af ukonventionel tværgående termoelektrisk generationFigur. (a) Skematisk diagram, der viser begrebet Seebeck-drevet tværgående termoelektrisk generation (STTG). Ladestrømmen forårsaget af Seebeck -effekten i det termoelektriske materiale genererer en s
Demonstration af ukonventionel tværgående termoelektrisk generationFigur. (a) Skematisk diagram, der viser begrebet Seebeck-drevet tværgående termoelektrisk generation (STTG). Ladestrømmen forårsaget af Seebeck -effekten i det termoelektriske materiale genererer en s
- Hvad sker der, når fossile brændstoffer brænder?
- Hvad er alt med i universet lavet af?
- Hvad er to ord, der betyder jord, vand, skove, planter og mineraler?
- Forskere fanger kryptonatomer for at danne en-dimensionel gas
- Hvad er studiet af kræfter luft på en krop i bevægelse?
- Hvordan ændrer giraffer og elefanter det afrikanske savannelandskab?


