Hvad er de kemiske reaktioner til konvertering af salt til klor?
Her er en sammenbrud af de involverede kemiske reaktioner:
1. Elektrolyse af saltvand:
* ved anoden (positiv elektrode):
* Chloridioner (CL⁻) mister elektroner og oxideres til klorgas:
2Cl⁻ → Cl₂ + 2e⁻
* ved katoden (negativ elektrode):
* Vandmolekyler (H₂O) får elektroner og reduceres til brintgas og hydroxidioner:
2H₂O + 2E⁻ → H₂ + 2OH⁻
2. Samlet reaktion:
* nettoreaktionen er:
2naCl + 2H₂O → Cl₂ + H₂ + 2NAOH
Denne reaktion producerer chlorgas (CL₂), brintgas (H₂) og natriumhydroxid (NaOH).
Vigtige noter:
* Elektrolyseprocessen kræver en jævnstrøm (DC) strømkilde.
* Brineopløsningen indeholder typisk en lille mængde natriumhydroxid for at forbedre ledningsevnen.
* Det producerede klorgas indsamles normalt og komprimeres til cylindre.
Andre metoder til fremstilling af klor:
Mens elektrolyse er den mest almindelige metode, findes der andre metoder til fremstilling af klor, herunder:
* Direkte klorering: Dette involverer at reagere et stof med klorgas.
* Oxidation af chloridioner: Denne metode bruger et oxidationsmiddel til at oxidere chloridioner til klorgas.
Disse metoder er imidlertid ikke så effektive eller vidt anvendt som elektrolyse.
 Varme artikler
Varme artikler
-
 Genetik indsats beriger ernæring af popcorn, sorghumNebraskas David Holding (til højre) og Leandra Marshall (til venstre) er ved at udvikle linjer af popcorn med højere niveauer af lysin, en aminosyre, der er essentiel for menneskers og nogle husdyrs k
Genetik indsats beriger ernæring af popcorn, sorghumNebraskas David Holding (til højre) og Leandra Marshall (til venstre) er ved at udvikle linjer af popcorn med højere niveauer af lysin, en aminosyre, der er essentiel for menneskers og nogle husdyrs k -
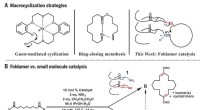 Efterligner enzymer, kemikere producerer store, nyttige carbonringeMakrocykliseringsstrategier. (A) Tidligere tilgange og foldamertilgang til makrocyklisering. (B) Divergent reaktivitet:Foldamer versus små molekyle katalyse. lign., ækvivalent(er). Kredit: Videnskab
Efterligner enzymer, kemikere producerer store, nyttige carbonringeMakrocykliseringsstrategier. (A) Tidligere tilgange og foldamertilgang til makrocyklisering. (B) Divergent reaktivitet:Foldamer versus små molekyle katalyse. lign., ækvivalent(er). Kredit: Videnskab -
 Nye elektronbriller skærper vores syn på atomare skala funktionerEn aberration-korrektionsalgoritme (nederst) gør atom probe tomografi (APT) på niveau med scanning transmission elektronmikroskopi (STEM) (øverst) - en industristandard - til karakterisering af urenhe
Nye elektronbriller skærper vores syn på atomare skala funktionerEn aberration-korrektionsalgoritme (nederst) gør atom probe tomografi (APT) på niveau med scanning transmission elektronmikroskopi (STEM) (øverst) - en industristandard - til karakterisering af urenhe -
 Ny undersøgelse finder unøjagtigheder i arseniske testsæt i BangladeshEfter en række trin med forskellige kemiske reagenser, farven, der udvikler sig på en teststrimmel, sammenlignes med et referenceskema leveret af sættets producent. En mørkere farve indikerer en højer
Ny undersøgelse finder unøjagtigheder i arseniske testsæt i BangladeshEfter en række trin med forskellige kemiske reagenser, farven, der udvikler sig på en teststrimmel, sammenlignes med et referenceskema leveret af sættets producent. En mørkere farve indikerer en højer
- Slingrenes kraft:At finde exoplaneter i stjernelysets skift
- Nanoskala samtaler skaber komplekse, flerlagsstrukturer
- Reproducerer frøer aseksuelt eller seksuelt?
- Tandem hedebølger, stormfloder i stigende grad batter kyster:Undersøgelse
- Nyt AI-system kan afkode frugtflueadfærd:Hvorfor det er afgørende for fremtidig forskning i mennes…
- Hvor mange atomer er der i 1 mol zinkatomer?


