Efterligner enzymer, kemikere producerer store, nyttige carbonringe
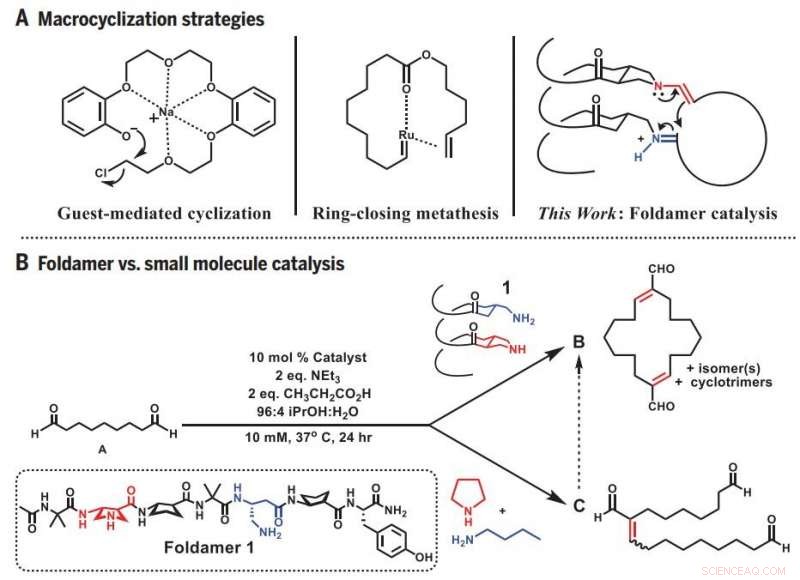
Makrocykliseringsstrategier. (A) Tidligere tilgange og foldamertilgang til makrocyklisering. (B) Divergent reaktivitet:Foldamer versus små molekyle katalyse. lign., ækvivalent(er). Kredit: Videnskab (2019).DOI:10.1126/science.aax7344
Henter inspiration fra naturen, University of Wisconsin-Madison kemikere har opdaget en effektiv måde at skændes længe, slangende molekyler til at danne store ringe – ringe, der danner rygraden i mange lægemidler, men som er svære at fremstille i laboratoriet.
Arbejdet kan repræsentere et foreløbigt fremskridt i retning af at dechifrere, hvordan enzymer, finpudset af evolution, så effektivt producere naturlige forbindelser. Mere umiddelbart, den nye metode kan hjælpe forskere med at syntetisere lægemidler, der har store ringrygrad, såsom dem til hepatitis. Forskningen er publiceret 19. december i tidsskriftet Videnskab .
Naturen foretrækker uorden af en lang, fleksibelt molekyle i størrelsesordenen en stiv ring, hvilket gør det notorisk svært for kemikere at lokke store ringe til at dannes i laboratoriet. "Hvis de lineære molekyler bliver lange nok, det er som om enderne ikke længere ved, at de er forbundet, og de er lige så tilbøjelige til at binde sig til andre molekyler, som de kommer sammen, " siger UW-Madison professor i kemi Sam Gellman, rapportens seniorforfatter.
Alligevel kan biologiske enzymer nemt bringe disse ender sammen og danne ringe i alle størrelser. De opnår denne bedrift takket være deres komplekse, tredimensionelle former, der fungerer som en specialiseret lås - det lineære molekyle passer på plads som en nøgle på den helt rigtige måde, for at en organiseret reaktion kan finde sted.
For både at studere, hvordan enzymer virker og efterligne deres evner, Gellmans team blev meget mindre, tredimensionelle proteinlignende molekyler kaldet foldamere, som deres laboratorium har hjulpet med at udvikle.
Fordi foldameren har en tredimensionel form, der kan gribe fat i enderne af det fleksible precursor-molekyle, det øger i høj grad chancerne for, at enderne finder hinanden. På samme tid, foldameren katalyserer den rigtige reaktion, der forbinder enderne til en lukket ring. Resultatet er ligetil og forudsigelig syntese af en udfordrende, og nyttigt, molekylær form.
"Som kemikere, vi ser, hvor ekstraordinært effektive enzymer er til at udføre reaktioner, der er svære at udføre i en kolbe, men vi forstår ikke rigtig, hvordan de fungerer, " siger Gellman. "Hvis vi lærer, hvordan disse små folddamer-katalysatorer virker, vi kan være i stand til at bygge katalysatorer, der er effektive til mange forskellige reaktioner. Ultimativt, måske kan vi starte vores vej mod foldamere, der har virkelig enzymlignende aktivitet."
Kandidatstuderende og hovedforfatter Zebediah Girvin begyndte forskningen ved at teste evnerne hos en kort, spiralformet folder. Girvin forsøgte at bruge foldameren til at bøje et lineært molekyle indeholdende ni carbonatomer, så det ville danne en ring. Men i stedet for en ring af den forventede størrelse, Girvin fik en dobbelt så stor - resultatet af to forløbermolekyler, der først sluttede sig sammen og derefter lukkede cirklen.
"Dette er en almindelig situation i videnskaben. Man prøver noget, og det virker ikke, som man havde forventet, " siger Gellman. "Udfordringen er at erkende, hvornår det overraskende resultat er lige så interessant som det oprindelige mål, eller endnu mere interessant."
Ledet af denne serendipity, Girvin begyndte at teste, hvor godt foldameren kunne producere de større ringe, den så ud til at foretrække at skabe. Han fandt ud af, at han let kunne fremstille ringe bestående af 12 til 22 kulstofatomer, når foldamerens reaktive steder, hvor ringlukningen sker, var stillet op med hinanden på den ene side. Denne orientering bragte de to ender af forskellige lineære molekyler tæt nok til at smelte sammen.
Som et proof-of-concept for den nye teknik, Girvin syntetiserede naturproduktet robustol fra bunden. Afledt af bladene fra det australske silkeagtige egetræ, robustol vejer ind med en heftig 22-atom ring.
Gellmans team er mest begejstrede for potentialet for foldammere til at katalysere andre nyttige reaktioner og muligvis hjælpe med at opklare mangeårige mysterier om, hvordan enzymer, naturens kemiske virtuoser, producere de molekyler, der kræves til livet, blot ved at arrangere aminosyrebyggesten i den rigtige form. Mens disse svar er år væk, den ringlukkende teknik, de har opdaget, kunne have mere umiddelbar brug ved at syntetisere lægemiddelkandidater. Hepatitis C-lægemidlet vaniprevir, som bruges i Japan og i de sene forsøg i USA, indeholder netop denne slags store ring.
Foldamernes reelle potentiale stammer fra deres mangfoldighed. Kemikere kan lave en næsten uendelig række af foldere i laboratoriet, fordi de har adgang til flere byggesten, end der findes i naturlige proteiner. Dette kunne give kemikere mulighed for at bygge mere nyttige katalysatorer, hvilket fik Gellman til at tage patent på visse foldamere og fandt virksomheden Longevity Biotech for at udforske deres terapeutiske anvendelser.
Fremadrettet, at et væld af muligheder vil give forskere mulighed for at arrangere disse katalysatorer i former, der sandsynligvis vil være nyttige på uventede måder. Kun mere forskning vil vise.
"Vi ved ikke rigtig, hvad disse katalysatorer er i stand til endnu, " siger Girvin. "Det vil tage år at finde ud af deres potentiale, og det er vigtigt, at vi kaster et bredt net ud og holder åbent sind om, hvad vi kan udrette med disse nye værktøjer."
 Varme artikler
Varme artikler
-
 En miljøvenlig måde at omdanne silicium til nanopartiklerKredit:Skolkovo Institute of Science and Technology Skoltech -forskere og deres kolleger fra Lomonosov Moscow State University (MSU) har udviklet en ny metode til genbrug af silicium. Deres forskn
En miljøvenlig måde at omdanne silicium til nanopartiklerKredit:Skolkovo Institute of Science and Technology Skoltech -forskere og deres kolleger fra Lomonosov Moscow State University (MSU) har udviklet en ny metode til genbrug af silicium. Deres forskn -
 Udvikling af en 3-D titanium-baseret struktur for at forbedre knogleimplantaterTitaniumimplantatet er belagt med en tredimensionel forgrenet nanostruktur, som bærer stoffer, der letter dannelsen af nyt væv. Kredit:Fundación Descubre Et forskerhold fra University of Malaga,
Udvikling af en 3-D titanium-baseret struktur for at forbedre knogleimplantaterTitaniumimplantatet er belagt med en tredimensionel forgrenet nanostruktur, som bærer stoffer, der letter dannelsen af nyt væv. Kredit:Fundación Descubre Et forskerhold fra University of Malaga, -
 Hvordan kommer ilt ind i en brændselscelle?Overfladen skabes ved hjælp af pulserende lasere. Kredit:TU Wien For at en brændselscelle skal fungere, det har brug for et oxidationsmiddel. TU Wien har nu fundet en måde at forklare, hvorfor ilt
Hvordan kommer ilt ind i en brændselscelle?Overfladen skabes ved hjælp af pulserende lasere. Kredit:TU Wien For at en brændselscelle skal fungere, det har brug for et oxidationsmiddel. TU Wien har nu fundet en måde at forklare, hvorfor ilt -
 Vil du diagnosticere hjernesygdomme? En massespektrometri -billeddannelse kan en dag hjælpe digFigur 1:(a) Skematisk af målesystemet udviklet i denne undersøgelse. Ved at bruge denne teknologi, udvinding og ionisering af picolitervolumener kan udføres uden forstyrrelser forårsaget af overflader
Vil du diagnosticere hjernesygdomme? En massespektrometri -billeddannelse kan en dag hjælpe digFigur 1:(a) Skematisk af målesystemet udviklet i denne undersøgelse. Ved at bruge denne teknologi, udvinding og ionisering af picolitervolumener kan udføres uden forstyrrelser forårsaget af overflader
- Er asteroider menneskehedens største udfordring?
- Google slutter sig til tech move east, at investere 1 mia. USD på campus i New York
- Flydende byer:Fremtiden eller en opvasket idé?
- En tredjedel af amerikanerne overvejer at bo i udlandet
- Hvordan virker et trissystem?
- En hjernetransplantation til et af Australiens bedste teleskoper


