Hvis temperaturen på en kemisk reaktion øges hastigheden?
* Øget kinetisk energi: Højere temperatur betyder, at molekyler har mere kinetisk energi, bevæger sig hurtigere og kolliderer oftere.
* mere succesrige kollisioner: Forøgede kollisioner fører til hyppigere og energiske interaktioner mellem reaktantmolekyler. Dette øger igen sandsynligheden for vellykkede kollisioner, der overvinder aktiveringsenergibarriere, hvilket fører til produktdannelse.
* Aktiveringsenergi: Aktiveringsenergien er den minimale energi, der kræves for at en reaktion kan forekomme. Forøget temperatur giver flere molekyler energi til at overvinde denne barriere.
Vigtige overvejelser:
* reaktionstype: Effekten af temperatur varierer lidt for forskellige typer reaktioner. For eksempel kan nogle reaktioner være mere følsomme over for temperaturændringer end andre.
* ligevægt: Mens stigende temperatur generelt øger reaktionshastigheden, kan den også flytte ligevægtspositionen for en reversibel reaktion.
Kortfattet: Højere temperaturer fører typisk til hurtigere kemiske reaktioner på grund af øgede molekylære kollisioner, højere energi og et større antal molekyler, der overvinder aktiveringsenergibarrieren.
Sidste artikelHvad er den første ionisering af hydrogensulfid?
Næste artikelHvad er den kemiske formel for ammoniak saltvand?
 Varme artikler
Varme artikler
-
 Hvis bare A.I. havde en hjerne - ingeniører modellerer en kunstig synapse efter den menneskelige hj…Pitt-ingeniører byggede en grafen-baseret kunstig synapse i en todimensionel, bikage -konfiguration af kulstofatomer, der viste fremragende energieffektivitet, der kan sammenlignes med biologiske syna
Hvis bare A.I. havde en hjerne - ingeniører modellerer en kunstig synapse efter den menneskelige hj…Pitt-ingeniører byggede en grafen-baseret kunstig synapse i en todimensionel, bikage -konfiguration af kulstofatomer, der viste fremragende energieffektivitet, der kan sammenlignes med biologiske syna -
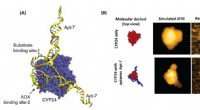 Lovende anticancer-molekyle identificeretFigur 1. En integreret tilgang til HS-AFM og molekylær docking for at afsløre bindingsmekanismen for Apt-7 til CYP24 (A) Den tredimensionelle visning af de toprangerede dockede konformationer af CYP24
Lovende anticancer-molekyle identificeretFigur 1. En integreret tilgang til HS-AFM og molekylær docking for at afsløre bindingsmekanismen for Apt-7 til CYP24 (A) Den tredimensionelle visning af de toprangerede dockede konformationer af CYP24 -
 Forskere designer opgraderingsenhed til massespektrometreSkoltech og MIPT-forsker Yury Kostyukevich, en af skaberne af den nye enhed. Kredit:Skoltech Forskere fra Skoltech og MIPT har udviklet en enhed til at opgradere massespektrometre, der bruges ti
Forskere designer opgraderingsenhed til massespektrometreSkoltech og MIPT-forsker Yury Kostyukevich, en af skaberne af den nye enhed. Kredit:Skoltech Forskere fra Skoltech og MIPT har udviklet en enhed til at opgradere massespektrometre, der bruges ti -
 Discovery kunne reducere nukleart affald med en forbedret metode til kemisk konstruktion af molekyle…Et triazolophan-molekyle med chlorid i midten suspenderet inde i en flydende opløsning. Et lignende billede vises på forsiden af 14. september-udgaven af tidsskriftet CHEM. Kredit:Yun Liu og Danny
Discovery kunne reducere nukleart affald med en forbedret metode til kemisk konstruktion af molekyle…Et triazolophan-molekyle med chlorid i midten suspenderet inde i en flydende opløsning. Et lignende billede vises på forsiden af 14. september-udgaven af tidsskriftet CHEM. Kredit:Yun Liu og Danny
- Hvor mange fødder pr. Sekund kan en bil rejse, hvis den rejser på 44 miles time?
- Radioaktive guldnanopartikler ødelægger prostatatumorer, Efterlader sundt væv urørt
- Vindenergi giver hurtig vækst, forklaret (opdatering)
- Er biomasse produceret i verden?
- Hvor mange dage er der i et år på Jupiter?
- De fysiske former for stof, der er fast flydende gas og plasma?


