Cesium Hvorfor blåt i alkali?
* stor atomradius: Cesium har den største atomradius blandt alle alkalimetaller. Dette betyder, at dets yderste elektron er længere væk fra kernen og oplever svagere tiltrækning.
* lav ioniseringsenergi: På grund af den svage attraktion begejstres den yderste elektron i cæsium let af endda lavenergifotoner.
* Absorption og genemission af lys: Når cesium absorberer lys, bliver elektronet ophidset til et højere energiniveau. Når det falder tilbage, udsender det lys, men dette udsendte lys er ved en lidt længere bølgelængde, der falder inden for den blå region af det synlige spektrum.
Her er en mere detaljeret forklaring:
1. excitation: Når hvidt lys skinner på cæsium, ophidser fotonerne i det synlige spektrum det yderste elektron til højere energiniveau.
2. Elektronovergang: Den ophidsede elektron falder hurtigt tilbage til sin jordtilstand og frigiver energi i form af lys.
3. Farveopfattelse: Da energiforskellen mellem den ophidsede og jordede tilstand af cæsium svarer til bølgelængder i den blå region, opfatter vi lyset, der udsendes som blåt.
Det er vigtigt at bemærke, at den blå farve ikke skyldes, at selve cæsiumet er blåt. Det er snarere resultatet af samspillet mellem cæsium og lys. Den blå farve, vi ser, er det lys, der blev genudgivet af cæsium, efter at det absorberede lys fra den hvide lyskilde.
Dette fænomen ligner, hvordan natriumgadelygter udsender et gult lys. Natrium udsender, når den er ophidset, også lys ved en bestemt bølgelængde, hvilket svarer til den gule farve, vi observerer.
Sidste artikelHvad er to former for fast nitrogen?
Næste artikelHvor mange elektroniske orbitaler har dette atomchlor?
 Varme artikler
Varme artikler
-
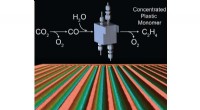 Effektive elektrokemiske celler til CO2-omdannelseDenne illustration er en kunstners gengivelse af elektrolyseprocessen, der bruges til at omdanne CO2 til koncentrerede kulstofprodukter. Kredit:Ripatti et al. Forskere ved Stanford University ha
Effektive elektrokemiske celler til CO2-omdannelseDenne illustration er en kunstners gengivelse af elektrolyseprocessen, der bruges til at omdanne CO2 til koncentrerede kulstofprodukter. Kredit:Ripatti et al. Forskere ved Stanford University ha -
 Biobaserede erstatninger til fossilt brændstofplastKredit:CC0 Public Domain BPA er en organisk forbindelse fremstillet af fossile brændstoffer. Det industrielle kemikalie er blevet brugt til at fremstille plast og harpiks siden 1950erne, og produk
Biobaserede erstatninger til fossilt brændstofplastKredit:CC0 Public Domain BPA er en organisk forbindelse fremstillet af fossile brændstoffer. Det industrielle kemikalie er blevet brugt til at fremstille plast og harpiks siden 1950erne, og produk -
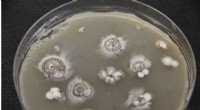 Forskere finder potentielle sygdomsbekæmpende sprænghoveder gemt i bakterierDyrkning af en thiocarboxylsyre producerende stamme af bakterier. Kredit:Shen Lab / The Scripps Research Institute Bakterier fundet i jord kan indeholde en potentiel game-changer for lægemiddeldes
Forskere finder potentielle sygdomsbekæmpende sprænghoveder gemt i bakterierDyrkning af en thiocarboxylsyre producerende stamme af bakterier. Kredit:Shen Lab / The Scripps Research Institute Bakterier fundet i jord kan indeholde en potentiel game-changer for lægemiddeldes -
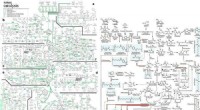 Et omfattende metabolisk kort til produktion af biobaserede kemikalierBiobaseret kemikalieproduktion ad biologiske og kemiske veje. Dette metaboliske kort beskriver repræsentative kemikalier, der kan fremstilles enten ved biologiske og/eller kemiske midler. Røde pile re
Et omfattende metabolisk kort til produktion af biobaserede kemikalierBiobaseret kemikalieproduktion ad biologiske og kemiske veje. Dette metaboliske kort beskriver repræsentative kemikalier, der kan fremstilles enten ved biologiske og/eller kemiske midler. Røde pile re
- En milliard bittesmå penduler kunne opdage universets manglende masse
- I hvilken retning og omkring hvilket tidspunkt på dagen stiger en måne i første kvartal?
- 1 Hvad betyder det at tage en truet art?
- Hvad får vand til at koge andet end varme?
- Hvilket udtryk definerer noget, der ikke overfører termisk energi effektivt?
- Hvad sker der, når et brintatom binder sig kovalent til et oxygen eller nitrogen tiltrækkes et and…


