Hvad får vand til at koge andet end varme?
1. Tryk:
* lavere tryk, lavere kogepunkt: Dette er den største faktor efter varme. Tænk på, hvordan vand koger ved en lavere temperatur på toppen af et bjerg. Det skyldes, at lufttrykket er lavere, hvilket gør det muligt for vandmolekyler at flygte lettere i luften.
* Højere tryk, højere kogepunkt: Omvendt fungerer trykkogere, fordi de fælder damp, hvilket øger trykket inde. Dette tvinger vandmolekyler til at forblive i flydende tilstand, hvilket kræver, at højere temperaturer koger.
2. Urenheder:
* opløste salte og mineraler: Tilsætning af salt til vand hæver kogepunktet lidt. Dette er grunden til, at havvand koger ved en lidt højere temperatur end frisk vand.
* Andre stoffer: Tilsætning af andre stoffer som sukker eller endda snavs kan også påvirke kogepunktet, men effekten er normalt lille.
3. Overfladespænding:
* rene overflader: Vand koger lettere på glatte, rene overflader.
* urenheder eller ruhed: Urenheder eller ru overflader kan hindre dannelse af boble, hvilket kræver lidt højere temperaturer for at koge.
4. Nukleationssteder:
* bobler har brug for et sted at starte: Bobler af damp har brug for et sted at danne, kaldet nucleationssteder. Disse kan være små luftbobler, ridser på beholderen eller urenheder i vandet.
* overophedning: Hvis der ikke er nogen gode nucleationssteder, kan vand undertiden blive varmere end dets normale kogepunkt uden kogning - et fænomen kaldet overophedning.
Kortfattet:
Mens varme er den primære drivkraft for kogning, kan faktorer som tryk, urenheder og overfladespænding alle påvirke den temperatur, hvormed vand overgår fra en væske til en gas.
Sidste artikelHvad er atomantallet af unnilennium?
Næste artikelHvordan forholder kuldioxid sig til temperaturen?
 Varme artikler
Varme artikler
-
 Enkeltpartikel-spektroskopi af CsPbBr3 perovskit afslører oprindelsen lavt elektroluminIntensitetstidsspor af fotoluminescens af et aggregat (midten, øverst) viser ingen udsving, fordi alle nanokrystaller i aggregatet udsender simuleret (midten, bundskema); Intensitetstidsspor af elektr
Enkeltpartikel-spektroskopi af CsPbBr3 perovskit afslører oprindelsen lavt elektroluminIntensitetstidsspor af fotoluminescens af et aggregat (midten, øverst) viser ingen udsving, fordi alle nanokrystaller i aggregatet udsender simuleret (midten, bundskema); Intensitetstidsspor af elektr -
 Design af hierarkiske nanoporøse membraner til højeffektive adsorptions- og opbevaringsapplikation…Fotografier af de hierarkiske nanoporøse membraner, der er skabt ved hjælp af en coatingbladsmetode. EN, Fotografi af stort område HNM (10 × 10 cm2) fremstillet ved en rakel-metode. B, Fotografi af fr
Design af hierarkiske nanoporøse membraner til højeffektive adsorptions- og opbevaringsapplikation…Fotografier af de hierarkiske nanoporøse membraner, der er skabt ved hjælp af en coatingbladsmetode. EN, Fotografi af stort område HNM (10 × 10 cm2) fremstillet ved en rakel-metode. B, Fotografi af fr -
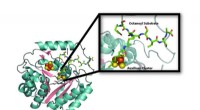 Vedvarende ressource:For at producere vital liponsyre, svovl bruges, derefter genopfyldesModel af krystalstrukturen af lipoylsyntaseenzymet (LipA) fra bakterierne Mycobacterium tuberculosis, der afslører ødelæggelsen af en af dens jern-svovlklynger (orange og gule kugler) til brug s
Vedvarende ressource:For at producere vital liponsyre, svovl bruges, derefter genopfyldesModel af krystalstrukturen af lipoylsyntaseenzymet (LipA) fra bakterierne Mycobacterium tuberculosis, der afslører ødelæggelsen af en af dens jern-svovlklynger (orange og gule kugler) til brug s -
 Kemikere bruger lys til at bygge biologisk aktive forbindelserSyntese af isoquinuclidiner ved hjælp af den blå LED-aktiverede fotokemi. Kredit:Jiajia Ma Nogle af de mest biologisk aktive molekyler, herunder syntetiske stoffer, indeholde en central, nitrogenh
Kemikere bruger lys til at bygge biologisk aktive forbindelserSyntese af isoquinuclidiner ved hjælp af den blå LED-aktiverede fotokemi. Kredit:Jiajia Ma Nogle af de mest biologisk aktive molekyler, herunder syntetiske stoffer, indeholde en central, nitrogenh
- Når kampagner mod affald slår igen
- Discoveries of the Paleolithic Age
- Forskere viser effektiviteten af en ny ikke -invasiv blodglukosetest
- Har en større kugle højere terminalhastighed?
- Forskere opdager potentiel bæredygtig energiteknologi til husholdningskøleskabet
- Daimlers overskud falder i 2019 på dieselgateomkostninger


