Vedvarende ressource:For at producere vital liponsyre, svovl bruges, derefter genopfyldes
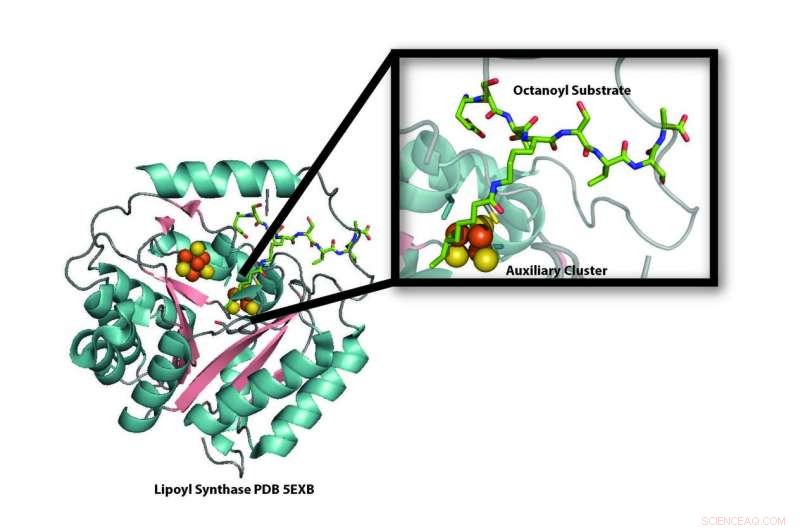
Model af krystalstrukturen af lipoylsyntaseenzymet (LipA) fra bakterierne Mycobacterium tuberculosis, der afslører ødelæggelsen af en af dens jern-svovlklynger (orange og gule kugler) til brug som svovlkilde til produktion af liposyre. Ny forskning viser, at jern-svovlklyngen, der ødelægges under produktionen af liponsyre, erstattes af et jern-svovlbærerprotein, NfuA, så LipA kan fortsætte med at producere liponsyre. Kredit:Booker -laboratorium, Penn State University
Ny forskning viser, hvordan et protein indtages og derefter rekonstitueres under produktionen af liponsyre, en forbindelse, der kræves af vores kroppe for at omdanne energi fra mad til en form, der kan bruges af vores celler. Lipoylsyntaseenzymet (LipA) fjerner to hydrogenatomer fra en inert kulkæde og erstatter dem med svovlatomer fra en af sine egne jern-svovlklynger for at danne liponsyre, gør sig selv inaktiv i processen. Den nye forskning fra Penn State University, som vil blive offentliggjort i tidsskriftet Videnskab den 20. oktober, 2017, viser, at et andet protein, en jern-svovl klynge bærer kaldet NfuA, erstatter den ødelagte jern-svovlklynge i LipA, tillader det at fortsætte med at producere liponsyre. Resultaterne kunne også hjælpe forskere med at forstå, hvorfor mennesker med defekter i jern-svovlbærergenet-en dødelig tilstand-har mangler i liponsyre.
"LipA kannibaliserer sig selv for at tilvejebringe de nødvendige svovlatomer til produktionen af liponsyre, "sagde Squire Booker, professor i kemi og biokemi og molekylær biologi ved Penn State University, en efterforsker ved Howard Hughes Medical Institute, og den tilsvarende forfatter til forskningspapiret. "Da vi demonstrerede dette i 2011, det var forvirrende, for hvis LipA ødelægges, hvordan kunne cellen lave nok liponsyre? "
LipA er medlem af den radikale SAM (S-adenosylmethionin) familie af enzymer. Ligesom de fleste radikale SAM -enzymer, den indeholder en klynge af fire jern- og fire svovlatomer, som den bruger til at omdanne SAM til en højenergiradikal. På tur, at radikal kan fjerne hydrogenatomer fra andre molekyler, et trin, der kræves for at aktivere mange vigtige cellulære metaboliske reaktioner. Hydrogenatomerne erstattes med svovl for at fuldføre processen.
Hvor svovlatomerne, som LipA bruger til at producere liponsyre, stammer fra, og hvordan de er knyttet, har været store spørgsmål på området. Hvordan andre enzymer binder iltatomer til inerte kulstofcentre er temmelig godt forstået. I disse tilfælde, ilt, som er allestedsnærværende tilgængelig i atmosfæren, bruges til at skabe radikaler med høj energi og er også kilden til det medfølgende iltatom. Svovl, på den anden side, findes ikke på samme måde, men i modsætning til de fleste andre radikale SAM -enzymer, LipA har en ekstra jern-svovlklynge.
"Vi vidste fra tidligere arbejde, at LipA brugte sin anden jern-svovlklynge som kilde til svovlatomer til at skabe liponsyre, "sagde Erin L. McCarthy, en kandidatstuderende i Bookers laboratorium og den første forfatter til papiret. "Men dette skabte et problem. Hvis LipA stjal svovlatomer fra sin egen jern-svovlklynge, enzymet ville blive ødelagt og derfor ikke kunne skabe mere liponsyre. Da vi lærte, at mennesker med defekte NFU1 -gener, den menneskelige ækvivalent af det bakterielle NfuA -gen, der blev brugt i vores eksperimenter, havde mangler i liponsyre, vi troede, at denne jern-svovlbærer kunne erstatte den forbrugte jern-svovlklynge i LipA, lad det fortsætte med at lave liponsyre. "
For at teste denne hypotese, forskerne udførte to centrale eksperimenter. Først, de testede, om LipA og NfuA associerer med hinanden ved at vurdere, hvor hurtigt molekylerne vandrer gennem en gel ved en teknik kaldet gelfiltreringskromatografi. I denne teknik, store molekyler vandrer hurtigere end mindre molekyler. Når LipA og NfuA blev kombineret og derefter analyseret ved denne teknik, de migrerede hurtigere, end et af molekylerne gør alene hvilket tyder på, at de to molekyler var bundet sammen til en større, hurtigere vandrende molekyle. Forskerne oprettede derefter en version af NfuA, der indeholdt en lidt anden form for svovl (34S frem for 32S) atomer, en form, som de kunne spore, hvis den blev inkorporeret i LipA og derefter i liponsyre. I dette andet forsøg, forskerne viste, at efter at 32S oprindeligt til stede i LipA blev forbrugt i den kemiske reaktion for at producere liponsyre, liponsyre blev produceret indeholdende 34S, som kun kunne være kommet fra deres konstruerede NfuA.
"Vi har længe været interesseret i både processen, der tilsætter svovl til en inert kulstofforbindelse til fremstilling af liponsyre og kilden til det tilsatte svovl, "sagde Booker." Liponsyre er en vital komponent i de grundlæggende metaboliske processer, der holder vores celler i live. At forstå reaktionen, der skaber den, giver os ikke kun mulighed for at forstå denne proces bedre, det giver os også indsigt i menneskelige sygdomme som den, der er forårsaget af mutationer i NFU1, der resulterer i mangel på liponsyre og død. "
 Varme artikler
Varme artikler
-
 Gel dråber til regenerativ medicinCellebærende geler lavet af selvsamlende ultrakorte peptider kan producere menneskelignende væv, der kan bruges til regenerative terapier. Kredit:KAUST; Gustavo Ramirez Calderon Geldråber i mikrom
Gel dråber til regenerativ medicinCellebærende geler lavet af selvsamlende ultrakorte peptider kan producere menneskelignende væv, der kan bruges til regenerative terapier. Kredit:KAUST; Gustavo Ramirez Calderon Geldråber i mikrom -
 Diagnostisk værktøj til coronavirus gør et vigtigt skridt fremadKredit:CC0 Public Domain Forskere ved University of Warwick har demonstreret, at et potentielt diagnostisk værktøj til at opdage COVID-19 ved hjælp af sukker vil fungere med en virus frem for kun
Diagnostisk værktøj til coronavirus gør et vigtigt skridt fremadKredit:CC0 Public Domain Forskere ved University of Warwick har demonstreret, at et potentielt diagnostisk værktøj til at opdage COVID-19 ved hjælp af sukker vil fungere med en virus frem for kun -
 At-Home Science: Color Mixing ExperimentDette hjemme-videnskabseksperiment er dejligt at prøve på en doven eftermiddag, når kedsomhed rammer. De dristige farver giver et imponerende resultat og kan bruges til en hurtig lektion i farveteori.
At-Home Science: Color Mixing ExperimentDette hjemme-videnskabseksperiment er dejligt at prøve på en doven eftermiddag, når kedsomhed rammer. De dristige farver giver et imponerende resultat og kan bruges til en hurtig lektion i farveteori. -
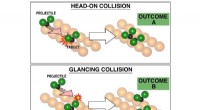 Kemikere fremmer evnen til at kontrollere kemiske reaktionerValget af påvirkningsparameteren er grundlæggende for resultatet af kemisk reaktion, som visualiseret her baseret på eksperimenter. Ved nul indvirkningsparameter, reaktionen øverst viste reproducerbar
Kemikere fremmer evnen til at kontrollere kemiske reaktionerValget af påvirkningsparameteren er grundlæggende for resultatet af kemisk reaktion, som visualiseret her baseret på eksperimenter. Ved nul indvirkningsparameter, reaktionen øverst viste reproducerbar
- Luftbilleder giver indsigt i vandtrends
- Hvad er reaktanterne og produkterne i en forbrændingsreaktion?
- Sådan laver du en hængende fuglføder Brug en Mason Jar
- På Twitter, begrænset antal tegn, der spreder falsk information
- Forskere antyder, at gamle bevarede kredsløb og nervesystemer i Kina faktisk er biofilm
- Kaster nyt lys på nanolasere ved hjælp af 2-D halvledere


