Hvorfor natrium er blødere end kobber, men begge er gode ledere?
Natriums blødhed
* Metallisk binding: Både natrium og kobber er metaller, hvilket betyder, at de udviser metallisk binding. I denne type binding delokaliseres og deles elektroner i hele krystalgitteret og danner et "hav af elektroner." Dette giver metaller mulighed for at udføre elektricitet og varme godt.
* svag metallisk binding i natrium: Imidlertid påvirkes styrken af metallisk binding af faktorer som antallet af valenselektroner og størrelsen på atomerne. Natrium har kun en valenselektron og en relativt stor atomradius. Dette resulterer i svagere metalliske bindinger sammenlignet med kobber.
* let glidning af atomer: De svagere bindinger i natrium betyder, at dets atomer let kan glide forbi hinanden under pres, hvilket gør det ganske bløde.
Kobberens hårdhed
* stærkere metallisk binding: Kobber har flere valenselektroner (en mere end natrium) og en mindre atomradius. Dette fører til stærkere metallisk binding mellem kobberatomer.
* Større modstand mod deformation: Den stærke binding i kobber gør det mere modstandsdygtigt over for deformation og dermed sværere.
begge er gode ledere
* Elektronmobilitet: Både natrium og kobber har et "hav af elektroner", der let bevæges af et elektrisk felt. Denne frie bevægelse af elektroner er nøglen til deres fremragende ledningsevne.
* lavere elektrisk modstand: De delokaliserede elektroner i begge metaller tilbyder lav modstand mod strømmen af elektricitet, hvilket gør dem til effektive ledere.
resume
Sodiumens blødhed opstår fra dens svagere metalliske binding på grund af dets lave antal valenselektroner og stor atomradius. Kobber, med stærkere limning, er sværere. Begge metaller udviser imidlertid god ledningsevne på grund af tilstedeværelsen af et fritflydende "hav af elektroner."
Sidste artikelHvilken forbindelse dannes, når zink og ilt kombineres?
Næste artikelHvad er to former for fast nitrogen?
 Varme artikler
Varme artikler
-
 Sådan opdager du nye materialer hurtigtVed samtidig at afsætte atomer fra tre eller flere retninger på et substrat, forskerne producerer såkaldte tyndfilmsmaterialebiblioteker. Kredit:RUB, Drießen Antallet af potentielle nye materialer
Sådan opdager du nye materialer hurtigtVed samtidig at afsætte atomer fra tre eller flere retninger på et substrat, forskerne producerer såkaldte tyndfilmsmaterialebiblioteker. Kredit:RUB, Drießen Antallet af potentielle nye materialer -
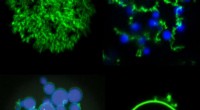 Varme og lys skaber nye biokompatible mikropartiklerBlandinger af POPer (grøn) og ELPer (blå) kan bruges til at skabe en række nye mikropartikelarkitekturer, herunder (med uret fra øverst til venstre) porøse partikler, frugt-på-vin-netværk, enkelte hul
Varme og lys skaber nye biokompatible mikropartiklerBlandinger af POPer (grøn) og ELPer (blå) kan bruges til at skabe en række nye mikropartikelarkitekturer, herunder (med uret fra øverst til venstre) porøse partikler, frugt-på-vin-netværk, enkelte hul -
 Elektrolytboost forbedrer ydeevnen af vandige dual-ion-batterierIsmael Rodríguez Pérez formulerede en ny type cellekemi til dual-ion batterier kaldet grafit||zink metal vandigt dual-ion batteri. Kredit:Andrea Starr | Pacific Northwest National Laboratory Udbre
Elektrolytboost forbedrer ydeevnen af vandige dual-ion-batterierIsmael Rodríguez Pérez formulerede en ny type cellekemi til dual-ion batterier kaldet grafit||zink metal vandigt dual-ion batteri. Kredit:Andrea Starr | Pacific Northwest National Laboratory Udbre -
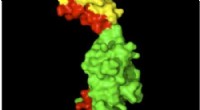 Nyt forskningsområde:Hvordan proteinstrukturer ændrer sig på grund af normale kræfterStrukturen af myomesin med elastiske områder vist med rødt. Kredit:Matthias Wilmanns Proteiner fremstillet i vores celler foldes i bestemte former, så de kan opfylde deres funktioner. Forskere h
Nyt forskningsområde:Hvordan proteinstrukturer ændrer sig på grund af normale kræfterStrukturen af myomesin med elastiske områder vist med rødt. Kredit:Matthias Wilmanns Proteiner fremstillet i vores celler foldes i bestemte former, så de kan opfylde deres funktioner. Forskere h
- Amazon-arbejderes medianløn i 2017:$28, 446
- Sådan fungerer Nysgerrighedsprojektet
- Sådan beregnes et temperaturområde
- Hvilket instrument bruges til at måle frekvens?
- I henhold til loven om bevaringsenergi kan hverken oprettes eller ødelægges. Hvis dette er sandt, …
- Hvad menes der med jordens permeabilitet?


