Nyt forskningsområde:Hvordan proteinstrukturer ændrer sig på grund af normale kræfter
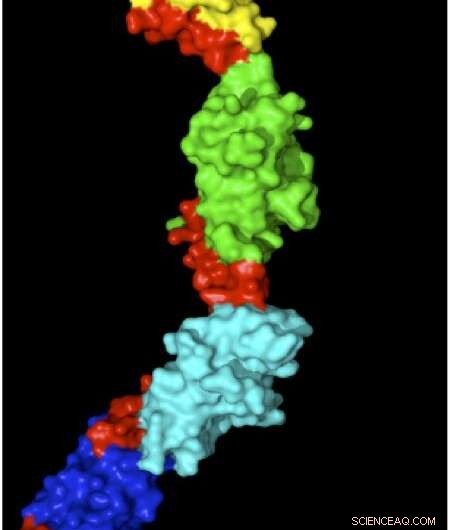
Strukturen af myomesin med elastiske områder vist med rødt. Kredit:Matthias Wilmanns
Proteiner fremstillet i vores celler foldes i bestemte former, så de kan opfylde deres funktioner. Forskere har opdaget de statiske strukturer på over 100, 000 proteiner, men hvordan de ændrer sig som reaktion på kræfter på cellen, som muskelsammentrækninger, er stort set ukendt. Matthias Wilmanns og kolleger på European Molecular Biology Laboratory i Hamburg, Tyskland, udviklet metoder til at studere strukturen af et protein "stammeabsorber", da det ændrer sig under muskelsammentrækninger. De vil præsentere deres arbejde på det 63. Biophysical Society årsmøde, afholdes den 2. - 6. marts, 2019 i Baltimore, Maryland.
Hver muskel enhed har en række stærkt organiserede proteinstænger, der trækkes til at overlappe hinanden, når en muskel trækker sig sammen eller trækkes fra hinanden, når en muskel strækkes. Myomesin er et protein, der stabiliserer og organiserer disse stænger, virker for at absorbere belastningen på strakte muskler for at forhindre muskel enhederne i at bryde fra hinanden. Wilmanns, i samarbejde med Matthias Riefs gruppe ved Münchens tekniske universitet, brugte atomkraftmikroskopi til at strække og måle individuelle myomesin -molekyler. Myomesin blev 2,5 gange længere under kraft, og deres struktur med høj opløsning viste, at dette skyldtes slank-lignende linkere i proteinet, der tillod det at strække sig uden at folde sig ud. Imidlertid, der er stadig et centralt spørgsmål om at demonstrere, at disse mekanismer også gælder under fysiologiske forhold. For at løse dette spørgsmål, Wilmanns og kolleger designer nu eksperimenter for at visualisere ændringer i myomesin inde i muskelceller ved hjælp af superhøj opløsning.
"Muskel er en god model til at se på, hvordan dets proteiner reagerer på kraft, fordi den oplever ekstraordinært høje kræfter, men vi har små kræfter over hele kroppen, "forklarede Wilmanns." Nu har vi metoder, der er følsomme nok til at måle meget små kræfter, så vi kan begynde at se på adfærden hos forskellige proteiner, der reagerer på meget små kræfter. På nuværende tidspunkt er der så lidt kendt om mekanismer for molekylær elasticitet i proteiner. "
Sidste artikelForskere kombinerer levende og livløse stoffer
Næste artikelEn meget følsom ny blodprøve kan påvise sjældne kræftproteiner
 Varme artikler
Varme artikler
-
 Forfalsket arganolie afdækket gennem ny analysemetodeKredit:CC0 Public Domain Forskere fra Quadram Institute har udviklet en ny måde at teste ægtheden af arganolie på, en af verdens dyreste spiseolier. I de seneste år, det er blevet eftertragtet
Forfalsket arganolie afdækket gennem ny analysemetodeKredit:CC0 Public Domain Forskere fra Quadram Institute har udviklet en ny måde at teste ægtheden af arganolie på, en af verdens dyreste spiseolier. I de seneste år, det er blevet eftertragtet -
 Afdækning af nye forhold mellem SLC'er og cytotoksiske lægemidler i humane cellerSolute Carriers (SLCer) påvirker optagelsen, metabolisme og virkningsmekanisme (MoA) af cytotoksiske lægemidler. Kredit:© Enrico Girardi / CeMM CeMM Forskere har undersøgt, hvordan solute carriers
Afdækning af nye forhold mellem SLC'er og cytotoksiske lægemidler i humane cellerSolute Carriers (SLCer) påvirker optagelsen, metabolisme og virkningsmekanisme (MoA) af cytotoksiske lægemidler. Kredit:© Enrico Girardi / CeMM CeMM Forskere har undersøgt, hvordan solute carriers -
 Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit
Kemiske jobsøgende står over for hårde udsigter under pandemienKredit:CC0 Public Domain Selvom det er over et årti, recessionen i 2008 og dens virkninger stadig hænger over kemi -virksomheden. Og nu med COVID-19-pandemien, der lukker laboratorier og universit -
 Makerspaces kunne muliggøre udbredt anvendelse af mikrofluidikMikrofluidiske enheder til at udføre forskellige assays blev skabt med værktøjerne i Lincoln Laboratorys Technology Office Innovation Laboratory. Kredit:Nicole Fandel I mere end et årti, videnskab
Makerspaces kunne muliggøre udbredt anvendelse af mikrofluidikMikrofluidiske enheder til at udføre forskellige assays blev skabt med værktøjerne i Lincoln Laboratorys Technology Office Innovation Laboratory. Kredit:Nicole Fandel I mere end et årti, videnskab
- Forskere hærder glas ved hjælp af nanopartikler
- 97 % af de oprindelige folk rapporterer, at de ser negativt indhold på sociale medier ugentligt
- For at forudsige vinterregn i sydvest, se til New Zealand om sommeren
- Forskere bruger AI til at tilføje 4-D-effekter til film
- Maskinlæringsmodeller af stof ud over interatomiske potentialer
- Det symbiotiske forhold mellem fikentræet og Amazonas frugtblade


