Hvor mange mol ammoniumioner er i 6,955?
Her er hvorfor:
* mol er et mål for mængden af stof. Vi er nødt til at vide, hvor meget af det stof, vi har til at beregne antallet af mol.
* koncentration fortæller os, hvor meget opløst stof opløses i en given mængde opløsningsmiddel. En opløsnings koncentration udtrykkes normalt i molaritet (M), som er mol af opløst stof pr. Liter opløsning.
For at beregne molen af ammoniumioner har du brug for et af følgende:
* Koncentrationen af ammoniumionopløsningen: Hvis du kender koncentrationen (i M) og volumen (i L) på opløsningen, kan du beregne molen af ammoniumioner ved hjælp af formlen:
mol =koncentration (m) x volumen (l)
* Massen af ammoniumforbindelsen: Hvis du kender massen af en ammoniumforbindelse (som ammoniumchlorid, NH₄Cl) og dets molekylvægt, kan du beregne molen af ammoniumioner ved hjælp af følgende trin:
1. Beregn molen af ammoniumforbindelsen.
2. Brug molforholdet mellem ammoniumforbindelsen og ammoniumionen til at bestemme molen af ammoniumioner.
Eksempel:
Lad os sige, at du har 250 ml af en 0,5 M ammoniumchlorid (NH₄CL) opløsning.
1. Konverter lydstyrken til liter:250 ml =0,25 l
2. Brug koncentrationen og volumenet til at beregne molen af ammoniumioner:
mol =0,5 m x 0,25 l =0,125 mol ammoniumioner
Angiv de manglende oplysninger, så jeg kan hjælpe dig med at beregne molen af ammoniumioner.
Sidste artikelHvordan skriver du en formel til platin IV -oxid?
Næste artikelHvorfor kaldes natrium et lysfølsomt metal?
 Varme artikler
Varme artikler
-
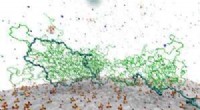 Et hårdt kig på polymerer i cementblandingComputermodeller har afdækket, hvordan superplastikere adsorberes på overfladen af cementpartikler. Kredit:Gengivet fra Ref. 1 og licenseret under CC BY 4.0 2018 T. Hirata et al. Modellering af,
Et hårdt kig på polymerer i cementblandingComputermodeller har afdækket, hvordan superplastikere adsorberes på overfladen af cementpartikler. Kredit:Gengivet fra Ref. 1 og licenseret under CC BY 4.0 2018 T. Hirata et al. Modellering af, -
 De miljømæssige omkostninger ved kontaktlinserKontaktlinser genvundet fra behandlet spildevandsslam kan skade miljøet. Kredit:Charles Rolsky Mange mennesker er afhængige af kontaktlinser for at forbedre deres syn. Men disse synskorrigerende e
De miljømæssige omkostninger ved kontaktlinserKontaktlinser genvundet fra behandlet spildevandsslam kan skade miljøet. Kredit:Charles Rolsky Mange mennesker er afhængige af kontaktlinser for at forbedre deres syn. Men disse synskorrigerende e -
 Kemisk sensor på basis af materialer, der besidder molekylær hukommelseEn kemisk sensor på basis af materialer, der besidder molekylær hukommelse. Kredit:Vita Nikitina Forskere fra det kemiske fakultet ved Lomonosov Moscow State University har udviklet en polymerbase
Kemisk sensor på basis af materialer, der besidder molekylær hukommelseEn kemisk sensor på basis af materialer, der besidder molekylær hukommelse. Kredit:Vita Nikitina Forskere fra det kemiske fakultet ved Lomonosov Moscow State University har udviklet en polymerbase -
 Kan vi helbrede kræft ved at finde ud af, hvordan to proteiner interagerer?Kredit:CC0 Public Domain I et papir offentliggjort i Journal of Biological Chemistry , Dr. Özdemir har undersøgt to proteinfamilier ved navn Rho GTPases og IQGAPer, som vides at spille en vigtig
Kan vi helbrede kræft ved at finde ud af, hvordan to proteiner interagerer?Kredit:CC0 Public Domain I et papir offentliggjort i Journal of Biological Chemistry , Dr. Özdemir har undersøgt to proteinfamilier ved navn Rho GTPases og IQGAPer, som vides at spille en vigtig


