Hvad er de 5 vigtige faktorer, der påvirker hastigheden for en kemisk reaktion?
1. Koncentration af reaktanter: Højere koncentrationer af reaktanter fører til hyppigere kollisioner mellem reaktantmolekyler, hvilket øger sandsynligheden for vellykkede reaktioner.
2. Temperatur: Forøgelse af temperaturen giver reaktantmolekyler mere kinetisk energi, hvilket resulterer i hyppigere og energiske kollisioner. Dette fører til en højere andel af kollisioner med nok energi til at overvinde aktiveringsenergibarriere, hvilket fremskynder reaktionen.
3. overfladeareal: For reaktioner, der involverer faste stoffer, udsætter forøgelse af overfladearealet af den faste reaktant mere af dets molekyler for de andre reaktanter, hvilket øger kollisionshastigheden og reaktionen. Tænk på, hvordan en træchip brænder langsommere end savsmuld.
4. tilstedeværelse af en katalysator: Katalysatorer fremskynder reaktioner uden at blive fortæret sig selv. De giver en alternativ reaktionsvej med en lavere aktiveringsenergi, hvilket øger den hastighed, hvormed molekyler kan overvinde energibarrieren.
5. Natur af reaktanter: De iboende egenskaber ved reaktanterne spiller selv en rolle. Nogle molekyler reagerer let, mens andre kræver mere energi for at bryde bindinger og danne nye. Den kemiske struktur og binding inden for reaktanterne påvirker sandsynligheden og hastigheden af reaktionen.
Sidste artikelHvor mange atomer i 1,84 g bi?
Næste artikelHvad er de ikke -giftige elementer?
 Varme artikler
Varme artikler
-
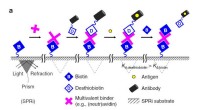 Bare at klikke et molekyle til et biomolekyle for en anden funktionEt desthiobiotin molekyle, inklusive antistof og et antigen, gør plads til biotin. Kredit:University of Twente Forskere har rapporteret et materiale, der styrer cellers adfærd på en dynamisk måde,
Bare at klikke et molekyle til et biomolekyle for en anden funktionEt desthiobiotin molekyle, inklusive antistof og et antigen, gør plads til biotin. Kredit:University of Twente Forskere har rapporteret et materiale, der styrer cellers adfærd på en dynamisk måde, -
 Udskiftning af funktionelle grupper med en guldelektrode for at kontrollere et molekyles reaktivitetIBS- og KAIST-forskere brugte guldelektroden og fastgjorde målmolekylerne på elektroden. Ligesom funktionelle grupper genererer forskellige elektroniske effekter, en elektrode passer til alle reaktion
Udskiftning af funktionelle grupper med en guldelektrode for at kontrollere et molekyles reaktivitetIBS- og KAIST-forskere brugte guldelektroden og fastgjorde målmolekylerne på elektroden. Ligesom funktionelle grupper genererer forskellige elektroniske effekter, en elektrode passer til alle reaktion -
 Et afgørende enzym blev endelig afsløretKredit:CEA Efter 40 års forskning, forskere ved CEA, CNRS, Universitetet i Grenoble-Alperne, Universitetet i Montpellier og Inserm har endelig identificeret det enzym, der er ansvarligt for tubuli
Et afgørende enzym blev endelig afsløretKredit:CEA Efter 40 års forskning, forskere ved CEA, CNRS, Universitetet i Grenoble-Alperne, Universitetet i Montpellier og Inserm har endelig identificeret det enzym, der er ansvarligt for tubuli -
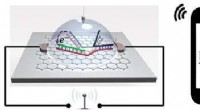 Biosensor -chip detekterer enkelt nukleotidpolymorfisme trådløst, med højere følsomhedIllustration af grafenbaseret SNP-detekteringschip, der trådløst sender signal til en smartphone. Kredit:Lal et al. Et team ledet af University of California San Diego har udviklet en chip, der ka
Biosensor -chip detekterer enkelt nukleotidpolymorfisme trådløst, med højere følsomhedIllustration af grafenbaseret SNP-detekteringschip, der trådløst sender signal til en smartphone. Kredit:Lal et al. Et team ledet af University of California San Diego har udviklet en chip, der ka
- Hvad kaldes en celle kraftcenter, fordi det nedbryder næringsstoffer for at hjælpe med at fremstil…
- Hvor mange inches i 0,345 mm?
- Længde på en dag på planeterne?
- Sabeltandede katte og bjørnehunde:Hvordan de fik samlivet til at fungere
- Lys gør skrivning til DNA-informationslagringsenhed
- Sticky partikler lover mere præcis lægemiddellevering til hjernekræft


