Hvor mange atomer i 1,84 g bi?
1. Find den molære masse af vismut:
* Den molære masse af vismut er ca. 208,98 g/mol.
2. Beregn antallet af mol:
* Opdel massen af vismut med dens molære masse:
* mol Bi =1,84 g / 208,98 g / mol ≈ 0,0088 mol
3. Brug Avogadros nummer:
* Avogadros nummer siger, at der er 6,022 x 10^23 atomer i en mol af ethvert stof.
* Multiplicer antallet af mol med Avogadros nummer:
* Atomer af Bi =0,0088 mol * 6,022 x 10^23 atomer/mol ≈ 5,3 x 10^21 atomer
Derfor er der ca. 5,3 x 10^21 atomer i 1,84 g vismuth.
Sidste artikelHvad gør svovl og fremstiller?
Næste artikelHvad er de 5 vigtige faktorer, der påvirker hastigheden for en kemisk reaktion?
 Varme artikler
Varme artikler
-
 Forskere fanger roaming molekylære fragmenter i realtidKredit:Pixabay/CC0 Public Domain Observation af en kemisk reaktion på molekylært niveau i realtid er et centralt tema i eksperimentel kemisk fysik. Et internationalt forskerhold har for første gan
Forskere fanger roaming molekylære fragmenter i realtidKredit:Pixabay/CC0 Public Domain Observation af en kemisk reaktion på molekylært niveau i realtid er et centralt tema i eksperimentel kemisk fysik. Et internationalt forskerhold har for første gan -
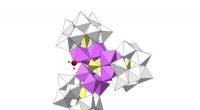 Kobolt og wolfram - nøglen til billigere, renere brintDen nye katalysator splitter vandmolekyler for at opnå brint og oxygen med meget lave spændinger. Kredit:ICIQ Elektrolyse, spaltning af vandmolekyler med elektricitet, er den reneste måde at få br
Kobolt og wolfram - nøglen til billigere, renere brintDen nye katalysator splitter vandmolekyler for at opnå brint og oxygen med meget lave spændinger. Kredit:ICIQ Elektrolyse, spaltning af vandmolekyler med elektricitet, er den reneste måde at få br -
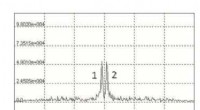 Forskere foreslår en ny metode til at opdage farlige nitrogenholdige væskerNMR -spektrum af mmoniumnitrat. Kredit:Galina Kupriyanova Et team af forskere fra Institut for Fysiske og Matematiske Videnskaber og Informationsteknologier ved Immanuel Kant Baltic Federal Univer
Forskere foreslår en ny metode til at opdage farlige nitrogenholdige væskerNMR -spektrum af mmoniumnitrat. Kredit:Galina Kupriyanova Et team af forskere fra Institut for Fysiske og Matematiske Videnskaber og Informationsteknologier ved Immanuel Kant Baltic Federal Univer -
 Forskere afslører strukturen af aminosyretransportør involveret i kræftForskere fra University of Groningen involveret i undersøgelsen - venstre til højre, stående:D.J. Slotboom, A. Guskov, A.A. Garaeva, C. Paulino - siddende:G.T. Oostergetel. Kredit:University of Gronin
Forskere afslører strukturen af aminosyretransportør involveret i kræftForskere fra University of Groningen involveret i undersøgelsen - venstre til højre, stående:D.J. Slotboom, A. Guskov, A.A. Garaeva, C. Paulino - siddende:G.T. Oostergetel. Kredit:University of Gronin
- Uden luftmodstand er alle objekter uanset deres størrelse og masseeksperience den samme acceleratio…
- 23 billioner dollars vil gå tabt, hvis temperaturen stiger fire grader inden 2100
- Nye molekylære fotoswitches med flere trin taget på fersk gerning
- Fordele og ulemper ved termisk kraft
- Forskere graver i oprindelsen af organiske stoffer på Ceres
- Eksempel på parallelle kredsløb


