Hvilke egenskaber har de fleste kovalente forbindelser til fælles?
Fysiske egenskaber:
* Lav smeltnings- og kogepunkter: Dette skyldes, at kræfterne, der holder molekylerne sammen (intermolekylære kræfter), er relativt svage sammenlignet med de stærke ioniske bindinger i ioniske forbindelser.
* dårlige ledere af elektricitet: Kovalente forbindelser har normalt ikke frit bevægende elektroner, som er nødvendige for elektrisk ledningsevne.
* Mange er gasser eller væsker ved stuetemperatur: Deres svage intermolekylære kræfter giver dem mulighed for at eksistere som gasser eller væsker snarere end faste stoffer.
* Ofte opløselig i ikke-polære opløsningsmidler: Som opløser som. Kovalente forbindelser, der er ikke-polære selv, har en tendens til at opløses i andre ikke-polære opløsningsmidler.
* Variabel hårdhed: Kovalente forbindelser kan variere fra meget hårdt (f.eks. Diamond) til meget blød (f.eks. Voks) afhængigt af det specifikke molekyle, og hvordan det interagerer med andre molekyler.
Kemiske egenskaber:
* form ved at dele elektroner: Dette er det definerende egenskab ved kovalent binding.
* findes ofte som diskrete molekyler: Atomerne i en kovalent forbindelse er forbundet sammen i specifikke arrangementer og danner forskellige molekyler.
* kan være ret reaktiv: Mange kovalente forbindelser deltager let i kemiske reaktioner og danner nye bindinger.
* kan være organisk eller uorganisk: Mens organiske forbindelser (indeholdende kulstof) næsten altid er kovalente, danner mange uorganiske forbindelser også kovalente bindinger.
Vigtig note: Dette er generelle egenskaber, og der er undtagelser fra hver. De specifikke egenskaber ved en kovalent forbindelse afhænger af de involverede atomer, strukturen af molekylet og styrken af de intermolekylære kræfter.
Sidste artikelEn klorion har en afgift på 1- Så hvad kan der udledes af ion?
Næste artikelHvor mange atomer er der i den sammensatte C2H4?
 Varme artikler
Varme artikler
-
 Undersøgelse afslører korrosionsmekanisme af magnesiumlegeringer i marine atmosfærisk miljøDe optiske fotografier af mikrostruktur for Mg-5Y-1.5Nd-xZn-0.5Zr (x = 0, 2, 4, 6 wt.%) legeringer. Kredit:Journal of Magnesium and Alloys (2022). DOI:10.1016/j.jma.2022.03.007 Magnesiumlegeringer
Undersøgelse afslører korrosionsmekanisme af magnesiumlegeringer i marine atmosfærisk miljøDe optiske fotografier af mikrostruktur for Mg-5Y-1.5Nd-xZn-0.5Zr (x = 0, 2, 4, 6 wt.%) legeringer. Kredit:Journal of Magnesium and Alloys (2022). DOI:10.1016/j.jma.2022.03.007 Magnesiumlegeringer -
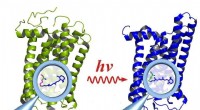 Ser komplekse molekyler på arbejdeRhodopsin før (venstre) og efter aktivering af lys (højre):Aktiveringen forårsager ændringer i funktionelle grupper inde i molekylet (forstørrelsesglas), som påvirker hele molekylet. Kredit:E. Ritter/
Ser komplekse molekyler på arbejdeRhodopsin før (venstre) og efter aktivering af lys (højre):Aktiveringen forårsager ændringer i funktionelle grupper inde i molekylet (forstørrelsesglas), som påvirker hele molekylet. Kredit:E. Ritter/ -
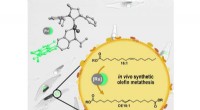 Alger som mikroskopiske bioraffinaderierKatalytisk olefinmetatese kan udføres i levende mikroalger. I denne proces omdannes fedtsyrer, der er lagret i algernes lipidorganeller, til polymerbyggesten og kemikalier. Kredit:Mecking Group Nog
Alger som mikroskopiske bioraffinaderierKatalytisk olefinmetatese kan udføres i levende mikroalger. I denne proces omdannes fedtsyrer, der er lagret i algernes lipidorganeller, til polymerbyggesten og kemikalier. Kredit:Mecking Group Nog -
 Nyt materiale til at overgå traditionelle oxygenreduktionsreaktionskatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. YANG Minghui ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) opdagede, at
Nyt materiale til at overgå traditionelle oxygenreduktionsreaktionskatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. YANG Minghui ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) opdagede, at
- Hvordan kan musik, dans og kunst være med til at forbedre luftforureningen?
- Hvorfor er der ingen kerne i RBC og blodplader?
- Hvilken fysiologisk tilpasning ville mindske transportprocessen i en plante?
- Hvordan lærer man et folkeskolebarn om samtykke? Du kan starte med disse bøger
- Forskere rapporterer om en ny og bedre form for usynlig blæk
- Amazon afslører næsten håndfri streaming-tv-enhed


