Ser komplekse molekyler på arbejde
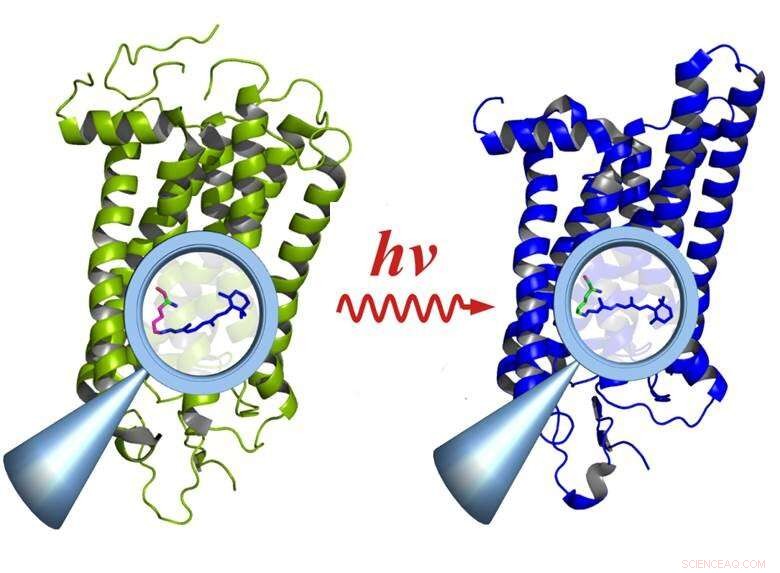
Rhodopsin før (venstre) og efter aktivering af lys (højre):Aktiveringen forårsager ændringer i funktionelle grupper inde i molekylet (forstørrelsesglas), som påvirker hele molekylet. Kredit:E. Ritter/HZB
Tidsopløst infrarød spektroskopi i sub-millisekundområdet er en vigtig metode til at studere forholdet mellem funktion og struktur i biologiske molekyler. Imidlertid, metoden virker kun, hvis reaktionen kan gentages mange tusinde gange. Dette er ikke tilfældet for et stort antal biologiske processer, selvom, fordi de ofte er baseret på meget hurtige og irreversible reaktioner, for eksempel i synet. Individuelle lette kvanta, der kommer ind i nethindens stænger, aktiverer rhodopsin -proteinmolekylerne, som derefter henfalder efter at have opfyldt deres fototransduktionsfunktion.
Nu har et team ledet af Dr. Ulrich Schade (HZB) og Dr. Eglof Ritter (Humboldt-Universität zu Berlin) ved IRIS beamline i BESSY II udviklet et nyt instrument, der kan registrere denne slags meget hurtige og/eller irreversible reaktioner med en enkelt måling. Tidsopløsningen er et par mikrosekunder. Instrumentet, et Féry -spektrometer, bruger en meget følsom detektor kendt som et fokalplan detektor array og speciel optik til at udnytte den strålende infrarøde stråling fra BESSY II synkrotronkilden optimalt. Teamet brugte denne enhed til at observere aktivering af rhodopsin under næsten in vivo-forhold for første gang.
"Vi brugte rhodopsin, fordi det irreversibelt henfalder efter at have været spændt af lys og derfor er en rigtig syretest for systemet, "forklarer Ritter, første forfatter til undersøgelsen. Rhodopsin er et proteinmolekyle, der fungerer som en receptor og er visionpigmentet, der findes i stængerne i øjets nethinde. Selv enkelte fotoner kan aktivere rhodopsin - hvilket gør det muligt for øjet at opfatte ekstremt lave lysniveauer. I øvrigt, rhodopsin er det fælles element i en klasse af receptorer med hundredvis af medlemmer, der er ansvarlige for lugten, smag, trykfornemmelse, hormonmodtagelse, osv. - alle fungerer på en lignende måde.
Teamet studerede også et andet spændende protein i det infrarøde område for første gang:actinorhodopsin. Dette molekyle er i stand til at omdanne lysenergi til en elektrisk strøm - en egenskab, som nogle bakterier bruger til at generere elektrokemisk energi til deres metabolisme.
"Den nye metode gør det muligt for os at undersøge de molekylære reaktionsmekanismer for alle irreversible processer (eller langsomme cykliske processer), såsom dem inden for energiomdannelse og -lagring, for eksempel, "understregede Schade, der leder IRIS -teamet.
 Varme artikler
Varme artikler
-
 Forskere udvikler open source-software til at analysere økonomien ved biobrændstoffer, bioprodukte…Ledende BioSTEAM-softwareudvikler Yoel Cortes-Pena. Kredit:Center for Avanceret Biobrændstof og Bioproduktinnovation (CABBI) Flerårige græsser kan omdannes til alt fra ethanol til bioplast, men de
Forskere udvikler open source-software til at analysere økonomien ved biobrændstoffer, bioprodukte…Ledende BioSTEAM-softwareudvikler Yoel Cortes-Pena. Kredit:Center for Avanceret Biobrændstof og Bioproduktinnovation (CABBI) Flerårige græsser kan omdannes til alt fra ethanol til bioplast, men de -
 Kemikere laver legedej / Lego-lignende hybrid for at skabe små byggeklodserComputergengivelser, der illustrerer designet af mikrostrukturerede partikler. Disse små objekter (1/4 af størrelsen en rød blodcelle) bliver først skabt inde i en computer ved hjælp af simuleringer o
Kemikere laver legedej / Lego-lignende hybrid for at skabe små byggeklodserComputergengivelser, der illustrerer designet af mikrostrukturerede partikler. Disse små objekter (1/4 af størrelsen en rød blodcelle) bliver først skabt inde i en computer ved hjælp af simuleringer o -
 En mere effektiv måde at spalte vedhængende olefiner fra terpener og lignende forbindelserKoncept og anvendelser af hydrodealkenylativ fragmentering af C(sp 3 )–C(sp 2 ) obligationer. (A) Dekonstruktiv fragmentering af C-C-bindinger. (B) Oversigt og foreslået mekanisme for hydrodealken
En mere effektiv måde at spalte vedhængende olefiner fra terpener og lignende forbindelserKoncept og anvendelser af hydrodealkenylativ fragmentering af C(sp 3 )–C(sp 2 ) obligationer. (A) Dekonstruktiv fragmentering af C-C-bindinger. (B) Oversigt og foreslået mekanisme for hydrodealken -
 Gennemsigtigt træ:fremtidens byggemateriale?Gennemsigtigt træ skabes ved at fjerne lignin fra træ og erstatte det med en polymer. Kredit:WILEY‐VCH Verlag GmbH &Co. KGaA, Weinheim, licenseret under CC BY-NC-ND 4.0 Da Timothée Boitouzet stude
Gennemsigtigt træ:fremtidens byggemateriale?Gennemsigtigt træ skabes ved at fjerne lignin fra træ og erstatte det med en polymer. Kredit:WILEY‐VCH Verlag GmbH &Co. KGaA, Weinheim, licenseret under CC BY-NC-ND 4.0 Da Timothée Boitouzet stude
- Det er altid en god hårdag for Leptothrix cholodnii
- Retssag i New York om Exxons klimaerklæringer
- Nano-imaging prober molekylær lidelse
- Raket ser krøllede bølger over den alaskanske himmel
- Virtuel virkelighed, der leverer værktøj til læse- og regnelæring i den virkelige verden
- Højeste spidseffekt og fremragende stabilitet demonstreret i en laser


