Hvad er komplet neutralisering af hypophosphorøs syre med natriumhydroxid?
Her er den afbalancerede kemiske ligning:
h₃po₂ (aq) + 2naOH (aq) → nah₂po₂ (aq) + 2H₂o (l)
Forklaring:
* hypophosphorosyre (H₃po₂) er en svag monoprotisk syre, hvilket betyder, at den kun kan donere en proton (H⁺) pr. Molekyle.
* natriumhydroxid (NaOH) er en stærk base, let dissocierer i natriumioner (Na⁺) og hydroxidioner (OH⁻) i opløsning.
* Under neutralisering reagerer hydroxidionerne fra NaOH med hydrogenionerne fra H₃po₂ og danner vand (H₂O).
* De resterende natriumioner (Na⁺) kombineres med hypophosphition (H₂po₂⁻) for at danne natriumhypophosphit (Nah₂po₂).
Nøglepunkter:
* Reaktionen er en syre-base neutraliseringsreaktion.
* Produkterne er et salt (natriumhypophosphit) og vand.
* Reaktionen er eksoterm og frigiver varme.
Bemærk: Den komplette neutralisering forekommer, når molen af NaOH tilsat er lig med dobbelt så meget mol af H₃po₂ til stede. Dette sikrer, at alle de sure protoner fra H₃po₂ neutraliseres af hydroxidionerne.
 Varme artikler
Varme artikler
-
 Giver brændte knogler liv igen ved hjælp af 3-D-teknologiKredit:CC0 Public Domain Retsmedicinere ved University of Portsmouth har opdaget en ny måde at præsentere skrøbelige beviser på, ved at rekonstruere et puslespil af menneskelige knoglefragmenter v
Giver brændte knogler liv igen ved hjælp af 3-D-teknologiKredit:CC0 Public Domain Retsmedicinere ved University of Portsmouth har opdaget en ny måde at præsentere skrøbelige beviser på, ved at rekonstruere et puslespil af menneskelige knoglefragmenter v -
 Forskere opnår direkte elektrokatalytisk reduktion af kuldioxid, skaber håb om smart kulstofopsaml…CO2 -reduktionsreaktionen finder sted i det katodiske kammer vist til højre. Kredit: Kemisk videnskab Kemikere ved Tokyo Institute of Technology (Tokyo Tech) har foreslået en innovativ måde at op
Forskere opnår direkte elektrokatalytisk reduktion af kuldioxid, skaber håb om smart kulstofopsaml…CO2 -reduktionsreaktionen finder sted i det katodiske kammer vist til højre. Kredit: Kemisk videnskab Kemikere ved Tokyo Institute of Technology (Tokyo Tech) har foreslået en innovativ måde at op -
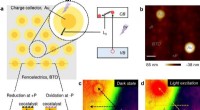 Forskere foreslår ny ladningsadskillelsesstrategi i ferroelektriske fotokatalysatorerLadningsadskillelse ved meta/ferroelektrisk grænseflade. et skematisk diagram af foreslået metal/ferroelektrisk fotokatalysator. b AFM-topografi af Au-partikler på en BaTiO3 enkelt krystal. Målestok,
Forskere foreslår ny ladningsadskillelsesstrategi i ferroelektriske fotokatalysatorerLadningsadskillelse ved meta/ferroelektrisk grænseflade. et skematisk diagram af foreslået metal/ferroelektrisk fotokatalysator. b AFM-topografi af Au-partikler på en BaTiO3 enkelt krystal. Målestok, -
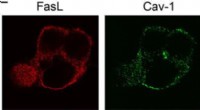 Forskere finder en måde at udsætte celledød påPlaceringen af fluorescensmærkede Fas-ligander (Fas-L) og caveolin (Cav-1) i cellen. Det sidste billede er overlapningen af Fas-L og Cav-1 (flet) kanalerne. Fremstillet ved laser konfokal scanning
Forskere finder en måde at udsætte celledød påPlaceringen af fluorescensmærkede Fas-ligander (Fas-L) og caveolin (Cav-1) i cellen. Det sidste billede er overlapningen af Fas-L og Cav-1 (flet) kanalerne. Fremstillet ved laser konfokal scanning
- Forskere opdager ny kemi, der kan hjælpe med at forklare cellelivets oprindelse
- Hvilken del af planten skaber frø
- Akamai udtaler sig om stigning i DDoS -angreb
- Hvordan planter udviklede sig til at gøre myrer til deres tjenere
- Forskere forklarer:Hvad er inerti fusionsenergi?
- Enhed, der producerer kliklyde eller blinkende lys ved at forstærke en elektrisk strøm dannet, nå…


