Forudsig og vælg de mest korrekte produkter dannet fra reaktion mellem jern III oxid kaliummetal?
reaktion:
Fe₂o₃ (S) + 6K (S) → 2Fe (S) + 3K₂O (S)
Forklaring:
* redoxreaktion: Kalium er et meget reaktivt alkalimetal, og det fungerer som et reduktionsmiddel. Det donerer let elektroner for at reducere jernioner i jern (III) oxid.
* Oxidation af kalium: Kalium mister elektroner og bliver oxideret til dannelse af kaliumoxid (K₂O).
* reduktion af jern: Jern (III) ioner (Fe³⁺) i jern (III) oxid får elektroner fra kalium og reduceres til elementært jern (Fe).
Produkter:
* Elemental Iron (Fe): Et solidt, gråt metal.
* kaliumoxid (K₂O): Et hvidt fast stof.
Vigtige overvejelser:
* varme og lys: Denne reaktion er meget eksoterm og vil producere en betydelig mængde varme og lys.
* sikkerhed: Denne reaktion er ekstremt farlig og bør kun udføres af uddannede fagfolk i et kontrolleret miljø.
* bivirkninger: Der er en mulighed for, at bivirkninger danner andre kaliumoxider som K₂O₂ (kaliumperoxid) og KO₂ (kaliumsuperoxid), især i nærvær af overskydende ilt.
Derfor er de mest korrekte produkter dannet fra reaktionen mellem jern (III) oxid og kaliummetal elementær jern (Fe) og kaliumoxid (K₂O).
 Varme artikler
Varme artikler
-
 Rettelse til synkrotronforskningsfejl kan forbedre resultaterneKurt Nienaber (tv) og Graham George. Kredit:University of Saskatchewan Forskere fra University of Saskatchewan har fundet ud af, at kemikalier, der normalt bruges til at beskytte prøver i synkrotr
Rettelse til synkrotronforskningsfejl kan forbedre resultaterneKurt Nienaber (tv) og Graham George. Kredit:University of Saskatchewan Forskere fra University of Saskatchewan har fundet ud af, at kemikalier, der normalt bruges til at beskytte prøver i synkrotr -
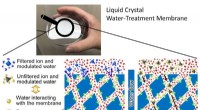 Meget selektive membraner:Forskere opdager, hvordan vand kan påvirke sin egen filtreringDen subnanoporøse væske-krystallinske vandbehandlingsmembran kan være meget selektiv med hensyn til, hvad den lader passere igennem. Kredit:Kato og Harada et al. Membraner med mikroskopiske porer
Meget selektive membraner:Forskere opdager, hvordan vand kan påvirke sin egen filtreringDen subnanoporøse væske-krystallinske vandbehandlingsmembran kan være meget selektiv med hensyn til, hvad den lader passere igennem. Kredit:Kato og Harada et al. Membraner med mikroskopiske porer -
 Insektantibiotikum giver en ny måde at fjerne bakterier påRygget soldaterfejl. Kredit:USDA/Wikmedia Commons Et antibiotikum kaldet thanatin angriber den måde, hvorpå den ydre membran af gramnegative bakterier er opbygget. Forskere ved universitetet i Zür
Insektantibiotikum giver en ny måde at fjerne bakterier påRygget soldaterfejl. Kredit:USDA/Wikmedia Commons Et antibiotikum kaldet thanatin angriber den måde, hvorpå den ydre membran af gramnegative bakterier er opbygget. Forskere ved universitetet i Zür -
 Noget ondt (lugtende) på denne måde kommer - videnskaben om stoffer og lugteTobi Richter og professor Raechel Laing. Kredit Sharron Bennett Forskere fra New Zealands universitet i Otago har brugt avanceret teknologi til at finde ud af, hvorfor tre almindelige fibertyper e
Noget ondt (lugtende) på denne måde kommer - videnskaben om stoffer og lugteTobi Richter og professor Raechel Laing. Kredit Sharron Bennett Forskere fra New Zealands universitet i Otago har brugt avanceret teknologi til at finde ud af, hvorfor tre almindelige fibertyper e
- Undersøgelse kvantificerer, hvordan cykloner bidrager til globale klimasystemer
- Hvad klassificeres ilt som?
- Den tyske presse nedgør afvigende røster om klimaændringer
- Hvad er de 4 stadier af et tordenvejr?
- Polarisering af nyheder om klimaændringer er ingen fup
- Biosfære: Definition, ressourcer, cykler, fakta og eksempler


